Tras recibir la opinión positiva del Comité de Medicamentos para Uso Humano de la Agencia Europea del Medicamento [CHMP y EMEA, respectivamente, en sus siglas en inglés] el pasado mes de julio (véase La Noticia del Día 29/07/2009), la Unión Europea ha aprobado esta semana la ampliación de la indicación del inhibidor de la integrasa raltegravir (Isentress®) a pacientes con VIH que no han tomado previamente tratamiento antirretroviral.
La decisión de ampliar la indicación a pacientes naïve se basa en los resultados a 48 semanas del estudio STARTMRK, un ensayo que comparó la combinación de raltegravir más tenofovir/emtricitabina (Truvada®) frente a uno de los antirretrovirales más ampliamente utilizado en la terapia de inicio, el no análogo de nucleósido efavirenz (Sustiva®) junto con tenofovir/emtricitabina. Los resultados mostraron que raltegravir tiene una eficacia y una seguridad similares a efavirenz en pacientes que no han tomado previamente tratamiento (véase La Noticia del Día 29/10/2008).
Los resultados a 48 semanas del estudio STARTMRK se han confirmado con los datos obtenidos a 96 semanas y que han sido presentados en la 49 Conferencia Interciencias sobre Agentes Antimicrobianos y Quimioterapia, que ha tenido lugar en San Francisco (EE UU) del 12 al 15 de septiembre.
En este estudio de fase III, multicéntrico y a doble ciego, 563 personas con VIH fueron distribuidas aleatoriamente para recibir ó 400mg de raltegravir dos veces al día (n= 281) ó 600mg de efavirenz una vez al día (n= 282), ambos administrados junto con la pareja de análogos de nucleósido tenofovir y emtricitabina.
El criterio de valoración principal de este estudio fue la indetectabilidad viral (<50 copias/mL) y la seguridad y la tolerabilidad a la semana 48. Entre los criterios de valoración secundarios, se incluyeron la actividad antirretroviral de raltegravir (definida como la proporción de participantes que lograron reducir la carga viral por debajo de 50 y 400 copias/mL), los aumentos en el recuento de CD4 desde el nivel basal, la tolerabilidad y la seguridad, todo ello a la semana 96.
Para poder participar en este estudio, los pacientes debían tener una carga viral superior a 5.000 copias/mL. A nivel basal, la media de la carga viral en el grupo de participantes que recibieron raltegravir fue de 103.205 copias/mL y de 106.215 copias/mL en el de efavirenz. La media en el recuento basal de CD4 fue de 218,9 células/mm3 entre los participantes a los que se administró raltegravir y de 214,4 células/mm3 entre los que tomaron efavirenz.
Tras 96 semanas de tratamiento, las tasas de pacientes que consiguieron reducir su carga viral hasta niveles indetectables (<50 copias/mL) fueron comparables en ambos regímenes: 81% en el grupo que tomó raltegravir y 79% en el de efavirenz. La diferencia en la reducción de la carga viral entre los dos grupos de tratamiento fue de un 2% (intervalo de confianza del 95% [IC95%]: de -4,3 a 9,0).
Los resultados también muestran que los participantes que recibieron raltegravir experimentaron mayores aumentos medios en el recuento de CD4 (240 células/mm3) que los que tomaron efavirenz (225 células/mm3); la diferencia entre los dos grupos fue de 15 células (IC95%: de -13 a 42).
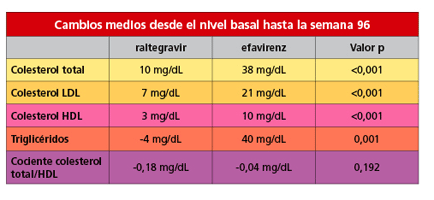
Respecto al perfil lipídico, los resultados ponen de manifiesto que raltegravir tuvo menor impacto sobre los niveles de lípidos (colesterol total, colesterol LDL —o colesterol ‘malo’—, colesterol HDL —o colesterol ‘bueno’— y triglicéridos) que efavirenz:
Un 47% de los participantes del grupo que recibió raltegravir experimentó efectos secundarios asociados a los fármacos frente a un 78% de los del grupo a los que se administró un régimen basado en efavirenz (p <0,001). Los efectos secundarios graves se dieron en un 14,2% de las personas que recibieron raltegravir y en un 12,1% de las que tomaron efavirenz (p= 0,457). Entre los pacientes a los que se administró raltegravir se produjeron tres muertes (1,1%), frente a ninguna en el grupo que tomó efavirenz. Los investigadores consideran que los fallecimientos (por sarcoma de Kaposi, cáncer de pulmón y hemorragia cerebral) no están asociados al tratamiento. Durante el estudio, se registraron 14 cánceres: 3 en el grupo de raltegravir (1,1%) y 11 en el de efavirenz (3,9%).
Los efectos secundarios que afectan al sistema nervioso central se dieron en 81 pacientes del grupo que tomó raltegravir (28,8%) y en 171 (60,6%) de los del grupo de efavirenz (p <0,001). Estos efectos fueron generalmente leves y pasajeros y, entre la semana 48 y 96, se produjeron con mucha menos frecuencia. Según los investigadores, los episodios de conducta suicida y depresión tuvieron lugar en una proporción similarmente baja en ambos grupos.
En sus conclusiones, los investigadores del estudio STARTMRK señalan que, en 96 semanas de tratamiento en personas con VIH sin experiencia previa en el uso de medicación antirretroviral, raltegravir mostró una eficacia potente, duradera y estadísticamente no inferior a efavirenz, y que este inhibidor de la entrada fue en general bien tolerado. Asimismo, añaden que la reducción de la carga viral a la semana 8 predijo el aumento del recuento de CD4 a la semana 48 y 96 en ambos grupos de tratamiento, aunque este hallazgo deberá confirmarse con los resultados de análisis posteriores.
Estos resultados de eficacia han sido respaldados por el análisis a 96 semanas del Protocolo 004, un ensayo que comparó también raltegravir con efavirenz en pacientes que nunca habían tomado medicación anti-VIH y que llegó a conclusiones similares (véase La Noticia del Día 21/07/2009).
Una vez concedida la aprobación de raltegravir como terapia de inicio por parte de la Unión Europea, empieza a continuación el proceso de negociación del precio entre el laboratorio farmacéutico (Merck Sharp & Dohme —MSD—) y las autoridades sanitarias de los estados miembros. Por ahora, se desconoce cuál va a ser su precio en primera línea de tratamiento. De mantenerse el mismo que tiene para pacientes pretratados (unos 27 euros diarios, lo que supone el triple de lo que cuesta efavirenz), éste podría constituir el principal obstáculo para que un número más grande de personas puedan beneficiarse de este medicamento. Según fuentes cercanas a MSD, la compañía estaría ahora considerando una rebaja del precio para facilitar así su uso en el tratamiento de inicio.
Fuente: Elaboración propia.
Referencias: Comunicado de prensa de MSD (15/09/09): La Comisión de la Unión Europea aprueba el uso ampliado de Isentress (raltegravir), de MSD, en pacientes adultos con infección por VIH-1.
Comunicado de prensa de MSD (13/09/09): Merck’s Isentre
ss (raltegravir) Tablets Studied in Comparison to Efavirenz in Combination Therapy Through 96 Weeks in HIV-1 Treatment-Naïve Patients.
Lennox J, DeJesus E, Lazzarin A, et al. Raltegravir demonstrates Durable Efficacy Through 96 Weeks: Results from STARTMRK, A Phase III Study of Raltegravir-based vs. Efavirenz-based Therapy in Treatment-Naïve HIV+ Patients. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC 2009). San Francisco. September 12-15, 2009. Abstract H-924b.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







