Según un comunicado de prensa distribuido la semana pasada por el laboratorio farmacéutico Janssen-Cilag, la Comisión Europea ha autorizado la comercialización en los 28 países de la Unión Europea de simeprevir (Olysio®), un inhibidor de la proteasa, de segunda generación, del virus de la hepatitis C (VHC) indicado en el tratamiento hepatitis C crónica en personas con genotipo 1 y 4.
Como es bien sabido, la aprobación no significa la disponibilidad inmediata del fármaco. Antes de que el medicamento pueda llegar al mercado de cada país, las autoridades nacionales competentes tendrán que autorizar su uso, un proceso que consiste, principalmente, en la negociación y la fijación del precio con el laboratorio farmacéutico.
La aprobación de simeprevir (y de hace unos meses sofosbuvir [Sovaldi®]) supone el inicio de lo que, se espera, sea algo frecuente en los próximos meses: la llegada de la segunda generación de fármacos de acción directa frente al VHC. Una serie de nuevos medicamentos con diversos mecanismos de acción capaces de mejorar la tasa de eficacia de la primera generación de los inhibidores de la proteasa [boceprevir (Victrelis®) y telaprevir (Incivo®)], con el valor añadido de acortar la duración de los tratamientos, de mejorar la tolerabilidad y de, potencialmente, crear regímenes libres de interferón y/o ribavirina.
La indicación de simeprevir aprobada por la agencia reguladora europea es el tratamiento de la infección crónica por el VHC de genotipo 1 y 4, a dosis de 150mg en una toma diaria y en combinación con otros medicamentos contra la hepatitis C tanto en pacientes monoinfectados como en los coinfectados por VIH:
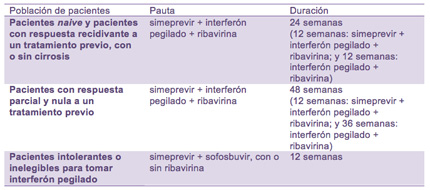
La decisión de la Comisión Europea se basa en los resultados de tres ensayos clínicos de fase III: QUEST-1 y QUEST-2, que compararon el tratamiento con simeprevir, interferón pegilado y ribavirina con el formado por únicamente biterapia (sin simeprevir) en personas con VHC de genotipo 1 sin experiencia en tratamientos (véase La Noticia del Día 27/05/2013) y el ensayo ASPIRE, con un diseño similar al de los estudios QUEST, pero llevado a cabo en personas con VHC de genotipo 1 que habían experimentado recidiva después de finalizar un ciclo de tratamiento previo o que habían tenido una respuesta parcial o nula a una tratamiento anterior.
Además, la aprobación también ha tenido en cuenta los resultados de la fase II del estudio COSMOS que evalúa el uso de la combinación simeprevir y sofosbuvir, con o sin ribavirina, en pacientes naive y en aquellos que tuvieron una respuesta nula a un tratamiento previo.
La Agencia de la Alimentación y el Medicamento de EE UU (FDA, en sus siglas en inglés) aprobó la comercialización de simeprevir a principios de diciembre de 2013 (véase La Noticia del Día 02/12/13). Su elevado coste –aproximadamente 66.360 dólares 12 semanas de tratamiento– continúa provocando las protestas de grupos de pacientes y activistas quienes alertan de que si no se rebaja el precio final o no se implementan planes específicos de descuentos, el coste desorbitado podría suponer un freno para su uso generalizado en EE UU y en el resto de países donde también estará disponible en breve. Habrá que esperar todavía unos meses para conocer el precio que tendrá simeprevir en los diferentes países que conforman la Unión Europea.
Además, y desafortunadamente, en este ocasión, la compañía no ha puesto en marcha ni programas de acceso expandido ni programas de uso compasivo que puedan facilitar el acceso temprano a simeprevir a los pacientes con hepatopatía avanzada y sin opciones terapéuticas que no pueden esperar la comercialización de dicho fármaco. Un error difícilmente entendible y justificable para una compañía que siempre ha apoyado los programas de acceso temprano a sus productos.
Fuente: Elaboración propia (gTt-VIH).
Referencia: Comunicado de prensa de Janssen-Cilag (16/05/14): Olysio™ (simeprevir) receives marketing authorisation in the European Union for the treatment of adults with hepatitis C genotype 1 and 4 infection.
Suscríbete a los boletines
Utiliza este formulario para suscribirte en los diferentes boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.








