Dos estudios revelan el impacto del uso de la terapia antirretroviral en la transmisión del VIH
Francesc Martínez / Xavier Franquet
Los resultados principales de dos estudios sobre el efecto del empleo de la terapia antirretroviral (TARV) en la transmisión del VIH y en los nuevos diagnósticos fueron presentados ayer al mediodía en rueda de prensa.
Uno de ellos, llevado a cabo con personas de siete países africanos, ha evaluado de forma prospectiva el riesgo de transmisión del VIH en 3.408 parejas serodiscordantes en función de si la persona con VIH tomaba o no TARV.
Deborah Donnell, del Centro de Investigación en Cáncer Fred Hutchinson de Seattle (EE UU), fue la encargada de presentar sus resultados ante la prensa.
Al inicio del ensayo, ninguno de los participantes cumplía los criterios nacionales para empezar el tratamiento anti-VIH. Durante el estudio, el 10% de los pacientes con VIH comenzaron la TARV. La proporción de personas que iniciaron la terapia antirretroviral fue mayor en hombres (12%) que en mujeres (9%), con una mediana en el recuento de CD4 de 192 y de 204 células/mm3, respectivamente.
Por otra parte, las personas que empezaron a tomar la TARV durante el estudio eran mayores y presentaban menores niveles de CD4 y una mayor carga viral al comienzo del mismo que quienes no empezaron a tomarla. En la mayoría de casos (52%), la TARV se inició con recuentos de CD4 inferiores a 200 células/mm3.
El seguimiento de las parejas duró 24 meses, período en el que, de forma trimestral, se evaluó la toma de la TARV por parte del miembro con VIH y se realizaron pruebas diagnósticas de la infección por este virus al miembro no infectado.
Tras el comienzo del tratamiento antirretroviral -con datos correspondientes a 256 persona-años-, sólo se dio un caso de transmisión del VIH, lo que supuso una seroincidencia del VIH -porcentaje de transmisiones por persona-años de seguimiento- de 0,39 [intervalo de confianza del 95% [IC95%]: 0,09-2,18]. En cambio, se observaron 102 transmisiones en parejas en las que la TARV no se había iniciado -datos correspondientes a 4.851 persona-años-, lo que supuso una seroincidencia del VIH de 2,23 (IC95%: 1,84-2,70).
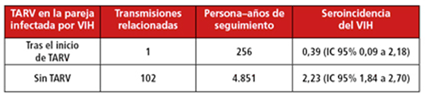
Estos resultados demuestran que el empleo de la terapia antirretroviral reduce notablemente el riesgo de transmisión del VIH en parejas africanas heterosexuales serodiscordantes. La única transmisión después de empezar la TARV tuvo lugar al cabo de 18 días.
 La otra investigación -esta vez un estudio retrospectivo-, presentada en la misma rueda de prensa por Moupali Das-Douglas, del Departamento de Salud Pública de San Francisco, ha analizado la relación entre la disminución de la carga viral en la población con VIH -parámetro definido como carga viral comunitaria (CVC)- de San Francisco (EE UU) y el número de nuevas infecciones.
La otra investigación -esta vez un estudio retrospectivo-, presentada en la misma rueda de prensa por Moupali Das-Douglas, del Departamento de Salud Pública de San Francisco, ha analizado la relación entre la disminución de la carga viral en la población con VIH -parámetro definido como carga viral comunitaria (CVC)- de San Francisco (EE UU) y el número de nuevas infecciones.
En el análisis se incluyeron datos del sistema de seguimiento del VIH/sida de la ciudad, lo que permitió obtener la CVC media y total y examinar la tendencia de ésta a escala global y en poblaciones determinadas. Estos datos se compararon con el número de nuevos diagnósticos de la infección (entre 2004 y 2008) y los cambios en la incidencia calculada de la infección por VIH entre 2006 y 2007.
Tanto la CVC media como la total se redujeron entre 2002 y 2008, y fueron acompañadas por descensos en la tasa de nuevas infecciones por VIH y en la incidencia de la infección.
La disminución de la CVC media se asoció significativamente con la reducción en el número de nuevos diagnósticos de la infección entre 2004 y 2008 (p= 0,003), además de con la incidencia decreciente de la infección por VIH entre 2006 y 2007 (p <0,0005).
La CVC total, por su parte, también se relacionó de forma significativa con el número de nuevos diagnósticos (p= 0,002) y con la incidencia de la infección (p <0,0005).
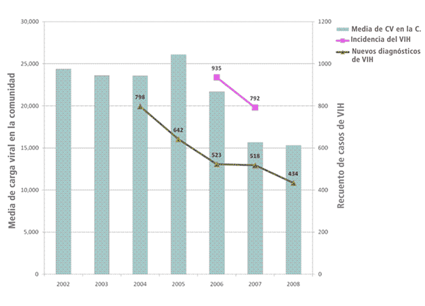
Los autores del estudio concluyeron que el incremento de las opciones terapéuticas, la cobertura sanitaria de la población con VIH y el acceso a pruebas diagnósticas conllevaron una disminución de la CVC en San Francisco, que se asoció a reducciones sustanciales en el número de nuevos diagnósticos y la incidencia de la infección.
Fuente: Elaboración propia.
Referencias: Donnell D, Kiarie J, Thomas K, Baeten J, Lingappa J, et al. ART and Risk of Heterosexual HIV-1 Transmission in HIV-1 Serodiscordant African Couples: A Multinational Prospective Study. 17th Conference on Retroviruses and Opportunistic Infections (CROI 2010). San Francisco, USA. February 16-19, 2010. Abstract 136.
Das-Douglas M, Chu P, Santos GM, Scheer S, McFarland W, et al. Decreases in Comm3unity Viral Load Are Associated with a Reduction in New HIV Diagnoses in San Francisco. 17th Conference on Retroviruses and Opportunistic Infections (CROI 2010). San Francisco, USA. February 16-19, 2010. Abstract 33
Nuevos datos sobre el riesgo de desarrollar cáncer en personas con VIH
Xavier Franquet
Los resultados de tres estudios presentados ayer son contundentes respecto al mayor riesgo de que las personas con VIH -que viven más tiempo gracias al tratamiento antirretroviral- acaben desarrollando, a lo largo de su vida, algunos cánceres no relacionados de forma directa, hasta ahora, con sida; es decir, que no figuran en la lista de enfermedades definitorias de sida.
Además del sarcoma de Kaposi -incluido en esta lista desde el principio de la epidemia-, el cáncer de ano, de boca y garganta, de pulmón o el linfoma de Hodgkin se suman a la lista de enfermedades posiblemente relacionadas con la inmunosupresión asociada a la infección por VIH.
Estos estudios han sido presentados en una sesión oral dedicada, en parte, a las malignidades vinculadas al VIH y proceden del análisis de datos de miles de pacientes de EE UU.
El primer estudio analizó la incidencia de cánceres asociados y no asociados con sida entre personas que habían superado un diagnóstico de este síndrome, así como el impacto que la terapia antirretroviral de gran actividad (TARGA) tenía en su incidencia en el tiempo.
El equipo de investigadores de Rockville (Maryland, EE UU) que realizó el estudio usó datos de más de 300.000 personas y los relacionó con 15 registros de cáncer de dicho país. El resultado de su investigación reveló que, mientras el riesgo de desarrollar cánceres asociados a sida (sarcoma de Kaposi, linfoma no de Hodgkin, cáncer de cuello de útero) empezaba a descender tres años después del diagnóstico de sida, el de padecer malignidades no relacionadas con sida, por el contrario, aumentaba en la primera mitad de la década de 1990, para luego permanecer estable -con una incidencia acumulativa del 1%- hasta 2006, diez años después de la introducción de la TARGA.
El segundo estudio al que nos referimos, llevado a cabo por un equipo de investigadores de la fundación Kaiser Permanente (un sistema de salud que incluye a más de 6 millones de californianos), comparó los datos de más de 20.000 personas con VIH de California [EE UU] con los de más de 200.000 controles sin VIH, desde 1996 hasta 2007.
Como en el caso del estudio anterior, los resultados de sus análisis muestran que el riesgo de padecer cáncer de ano, de boca y garganta, de pulmón o linfoma de Hodgkin era superior entre las personas con VIH, sobre todo en aquéllas con recuentos más bajos de linfocitos CD4 (<200 células/mm3).
En el caso del cáncer anal y del linfoma de Hodgkin, el riesgo se mantenía alto incluso con recuentos de CD4 por encima de 500 células/mm3. En cambio, tener una carga viral alta sólo se asoció con un aumento del riesgo de sufrir cáncer de boca y garganta y no con el resto de malignidades.
El cáncer de próstata, el colorrectal o los melanomas no se asociaron ni con los recuentos de CD4 ni con la carga viral.
Una tercera investigación que sólo estudió la relación entre VIH y cáncer de pulmón también llegó a conclusiones similares, incluso después de ajustar los resultados según el hábito de fumar.
En este caso, fueron comparados datos de más de 3.000 personas con VIH de EE UU con casi 10.000 personas sin el virus. En general, la incidencia de cáncer entre las personas con VIH fue de 0,26 por 100 persona-años, mientras que entre los casos sin VIH fue de 0,16 por 100 persona-años. El riesgo se mantenía significativamente más elevado tras ajustar por el consumo de tabaco, la edad, el origen étnico y padecer enfermedad pulmonar obstructiva crónica (EPOC).
La acumulación de datos en el mismo sentido debería ya trasladarse a los centros hospitalarios con programas de prevención y detección precoz de estos cánceres en personas con VIH. El inicio avanzado del tratamiento podría también desempeñar un papel importante en la reducción de la incidencia.
Fuente: Elaboración propia.
Referencias: Simard E, Pfeiffe R, Engels E.Cancer Incidence and Cancer-attributable Mortality among Persons with AIDS in the US. 17thConference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Abstract 27.
Silverberg M, Xu L, Chao C, et al. US Imm3unodeficiency, HIV RNA Levels, and Risk of Non-AIDS-defining Cancers. 17thConference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Abstract 28.
Sigel K, Wisnivesky J, Justice A, Brown S, et al. HIV Infection Is an Independent Risk Factor for Lung Cancer. 17th Conference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Abstract 30.
El comprimido antirretroviral cuádruple (Quad) y el potenciador GS-9350 se muestran eficaces y seguros en dos ensayos de fase II
Juanse Hernández, desde San Francisco (EE UU) – 18/02/2010
Un nuevo tratamiento experimental que combina en un único comprimido cuatro fármacos distintos (conocido en inglés como Quad) muestra una tasa elevada de supresión viral al compararlo con Atripla®, el único comprimido disponible actualmente que contiene un régimen antirretroviral completo (efavirenz, tenofovir y emtricitabina). Este nuevo compuesto, que está siendo desarrollado por Gilead Sciences, contiene elvitegravir (un inhibidor de la integrasa en investigación), GS-9350 (o cobicistat, un potenciador de los niveles de elvitegravir también experimental), tenofovir y emtricitabina.
En una presentación de última hora (late breaker) se han ofrecido los resultados de dos estudios prospectivos de fase II, doble ciego, doble placebo y con brazo control en pacientes sin experiencia previa en el uso de medicación antirretroviral, que comparan:
- Quad con Atripla® (estudio 236-0104).
- 150mg de GS-9350 con 100mg de ritonavir (Norvir®), ambos como potenciadores de atazanavir (Reyataz®), administrados además junto con tenofovir y emtricitabina (Truvada®) [estudio 216-0105].
Los participantes del ensayo debían cumplir los siguientes criterios de inclusión: carga viral igual o superior a 5.000 copias/mL, recuentos de CD4 iguales o superiores a 50 células/mm3 y no presentar resistencia a análogos de nucleósido (ITIN), a no análogos de nucleósido (ITINN) o a inhibidores de la proteasa (IP). En ambos estudios, el criterio de valoración principal fue la proporción de participantes que conseguían la indetectabilidad viral a la semana 24.
Los resultados de los dos estudios se muestran en la siguiente tabla:
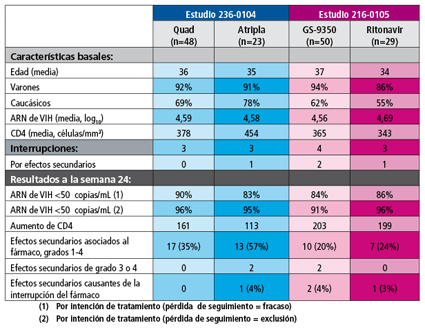
Según los investigadores, en el estudio 236-0104, Quad se mostró no inferior a Atripla® en términos de eficacia y, por lo que respecta a la seguridad, el comprimido cuádruple obtuvo una tasa más baja de efectos secundarios asociados al fármaco que Atripla®. GS-9350 se mostró eficaz como potenciador del inhibidor de la integrasa elvitegravir.
En el estudio 216-0105, los resultados ponen de manifiesto que GS-9350 consiguió una eficacia y seguridad similares a ritonavir como potenciador de atazanavir. No obstante, pese a que la tasa general de efectos secundarios fue menor entre las personas que recibieron GS-9350, los datos presentados muestran, por ejemplo, que la tasa de acontecimientos adversos gastrointestinales (un efecto bien conocido asociado a ritonavir) fue más o menos similar en ambos brazos del estudio (6% en el de GS-9350 frente a 10% en el de ritonavir). Asimismo, los investigadores también observaron que el uso de este nuevo potenciador podría estar asociado a toxicidad renal, en concreto, a elevaciones de la creatinina en suero. Se espera que todos estos aspectos relativos al perfil de toxicidad de GS-9350 puedan conocerse mejor en la fase III de ambos ensayos clínicos.
Fuente: Elaboración propia.
Referencia: Cohen C, Shamblaw D, Ruane P, et al. Single-tablet, Fixed-dose Regimen of Elvitegravir/Emtricitabine/Tenofovir Disoproxil Fumarate/GS-9350 Achieves a High Rate of Virologic Suppression and GS-9350 Is an Effective Booster .17th Conference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Oral abstract 58LB.
Darunavir una vez al día en personas con VIH pretratadas
Juanse Hernández
Darunavir (Prezista®) es un inhibidor de la proteasa cuya dosis recomendada en personas pretratadas es de 600mg junto con 100mg de ritonavir (Norvir®), ambos tomados dos veces al día. Sin embargo, una serie de pacientes con experiencia en tratamientos que no presentan mutaciones de resistencia asociadas a darunavir podrían beneficiarse de una pauta de dosificación menor: 800/100mg una vez al día, la misma que se utiliza en pacientes naive.
El estudio ODIN (TMC114-C229) es un ensayo abierto, de fase IIIb y de distribución aleatoria, que compara la eficacia, seguridad y tolerabilidad de 800/100mg de darunavir/ritonavir una vez al día con 600/100mg dos veces al día a la semana 48 en pacientes con VIH pretratados que no presentan mutaciones de resistencia asociadas a estos inhibidores de la proteasa. Los participantes recibieron, además, una terapia de base optimizada (TBO) formada por dos o más análogos de nucleósido. El objetivo principal de este estudio fue demostrar la no inferioridad de la dosificación de una vez al día respecto a la de dos veces al día a la semana 48 en esta población de pacientes.
Los participantes debían cumplir los siguientes criterios de inclusión: una carga viral superior a 1.000 copias/mL, un recuento de CD4 por encima de 50 células/mm3 y no presentar mutaciones de resistencia a darunavir. Las características basales de los 590 participantes fueron bastante similares en ambos brazos de tratamiento. La media de la carga viral basal fue de 4,16 log10 copias/mL y la mediana en el recuento de CD4, de 228 células/mm3. En general, un 46% de los participantes no tenían experiencia con el uso de inhibidores de la proteasa (IP) y un 13%, con el de inhibidores de la transcriptasa inversa no análogos de nucleósido (ITINN). Además, el virus de un 85,2% de los pacientes en el brazo de una vez al día y de un 86,1% en el de dos veces al día era sensible a 8 inhibidores de la proteasa (distintos a ritonavir).
Los resultados se muestran en la siguiente tabla:
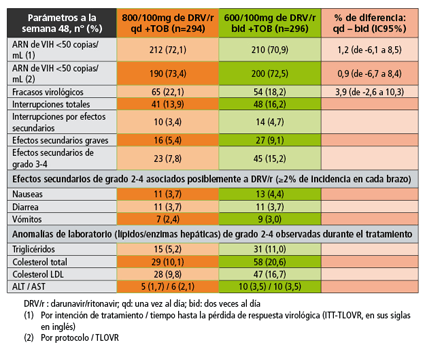
Sobre la base de estos resultados, los investigadores concluyen que la pauta de dosificación de 800/100mg de darunavir/ritonavir una vez día se mostró no inferior a la de 600/100mg dos veces al día. Además, señalan que la incidencia de elevaciones lipídicas con la dosis de una vez al día fue aproximadamente la mitad que con la de dos veces al día. Por estos motivos, consideran que sus hallazgos confirman que la dosis reducida de una sola toma diaria de darunavir/ritonavir puede ser una opción segura y eficaz en personas con VIH pretratadas que no presentan mutaciones de resistencia asociadas a este inhibidor de la proteasa.
En el turno de preguntas, Christine Katlama ha sugerido que, dado que una proporción elevada de los participantes de este estudio no mostraban mutaciones primarias de resistencia a los inhibidores de la proteasa, hubiera sido útil ofrecer los datos de eficacia estratificados por mutaciones de resistencia a IP basales, una información que ayudaría a entender mejor cómo aplicar esta estrategia de cambio de pauta de dosificación en la práctica clínica.
Fuente: Elaboración propia.
Referencia: Cahn P, Fourie J, Grinsztejn B et al. Efficacy and Safety at 48 Weeks of Once-daily vs Twice-daily DRV/r in Treatment-experienced HIV-1+ Patients with No DRV Resistance-associated Mutations: The ODIN Trial. 17th Conference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Oral abstract 57.
Vicriviroc no logra mostrar su eficacia en dos ensayos de fase III
Juanse Hernández
Tal como informamos días atrás en este servicio de noticias (La Noticia del Día 27/01/2010), los estudios VICTOR-E3 y VICTOR-E4, que evaluaron la toma de 30mg de vicriviroc una vez al día en combinación con una terapia de base optimizada (TBO) que incluía un inhibidor de la proteasa y, como mínimo, dos fármacos a los que el VIH de los participantes fuera susceptible, no han logrado evidenciar la superioridad de este régimen frente a otro que incluyó la misma TBO junto con placebo.
Los resultados ponen de manifiesto que la diferencia entre los porcentaje de pacientes que lograron reducir su carga viral hasta niveles indetectables (<50 copias/mL) a la semana 48 no fue estadísticamente significativa (64% en el grupo que recibió TBO+vicriviroc y 61% en el grupo que tomó placebo; p= 0,6). El poder incluir en la TBO fármacos de aprobación reciente altamente eficaces frente a virus resistentes (como darunavir/ritonavir [Prezista®/Norvir®] y/o raltegravir [Isentress®] implicó que muchos pacientes acabaran teniendo 3 ó 4 fármacos activos, lo que dificultó la comparación entre ambos brazos.
En un grupo de 261 pacientes con sólo dos fármacos o menos activos en su TBO sí se pudo demostrar la eficacia de vicriviroc (70%) frente a placebo (55%) [p= 0,02].
Como consecuencia de estos resultados, Merck, la compañía que en la actualidad desarrolla vicriviroc, ha decidido no solicitar su aprobación en pacientes con VIH pretratados a la Agencia de la Alimentación y el Medicamento de EE UU [FDA, en sus siglas en inglés]. No obstante, la compañía continuará con el desarrollo de este inhibidor del correceptor CCR5 en pacientes naive, es decir, como parte de un régimen de inicio.
Fuente: Elaboración propia.
Referencia: Gathe J, Diaz R, Fatkenheuer G, et al. Phase 3 Trials of Vicriviroc in Treatment-experienced Subjects Demonstrate Safety but Not Significantly Superior Efficacy over Potent Background Regimens Alone.17th Conference on Retroviruses and Opportunistic Infections. February 16-19, 2010. San Francisco. Oral abstract 54LB.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







