Los nuevos antivirales de acción directa contra el virus de la hepatitis C (VHC) y su empleo en personas coinfectadas por VIH fueron uno de los platos fuertes de ayer jueves en el transcurso de la XIV Conferencia Europea del Sida (EACS 2013).
Existe entre médicos y pacientes un gran interés y preocupación respecto al tratamiento de la hepatitis C en los pacientes con VIH, dado que muchas personas coinfectadas que adquirieron el VHC a través del uso de drogas inyectables en la juventud podrían encontrarse en la actualidad en estadios avanzados de enfermedad hepática y, por lo tanto, con una imperiosa necesidad de tratar su enfermedad. La progresión de la hepatopatía es más rápida y la respuesta a la terapia convencional (interferón pegilado y ribavirina [IFN-PEG y RBV]) es más limitada en pacientes coinfectados por VIH y VHC que en los que solo tienen hepatitis C.
La aprobación de los dos primeros agentes antivirales de acción directa (DAA, en sus siglas en inglés) frente a la hepatitis C de genotipo 1 –boceprevir (Victrelis®) y telaprevir (Incivo®)– ha incrementado las expectativas de tratar, esta vez con éxito, la hepatitis C. Este renovado optimismo, sin embargo, ha sido frenado por los retos que implica el empleo de la terapia triple basada en boceprevir o telaprevir en pacientes coinfectados, sobre todo por las frecuentes interacciones farmacológicas y las elevadas tasas de toxicidad, además de los problemas de acceso, puesto que estos nuevos fármacos todavía no han obtenido la indicación de uso en esta población de pacientes por parte de las autoridades reguladoras.
Los nuevos antivirales de acción directa contra el VHC, que presentan un mejor perfil de eficacia y tolerabilidad, todavía se encuentran en fase de desarrollo en personas coinfectadas, y algunos de ellos continúan necesitando combinarse con la terapia estándar basada en interferón pegilado y ribavirina.
Según Diego García, presidente del Foro Español de Activistas en Tratamientos del VIH (FEAT) y del Grupo Europeo sobre Tratamientos del Sida (EATG), es una oportunidad poder conocer en este tipo de conferencias los resultados preliminares que evalúan la eficacia y la seguridad de los nuevos agentes contra la hepatitis C en personas con VIH.
 “Desafortunadamente, siguen siendo pocos los ensayos clínicos dirigidos a las personas que vivimos coinfectadas por VIH y VHC, a pesar de ser una población con una extrema urgencia de nuevas opciones terapéuticas”, declara Diego García. Según el presidente de FEAT, el esfuerzo y empeño que los activistas han puesto estos años ha sido fundamental para impulsar el desarrollo de estos nuevos fármacos, y considera que pronto se dispondrá de combinaciones con o sin interferón pegilado también en personas coinfectadas. “Esperemos que esta ventana abierta a la esperanza no se cierre para muchos de nosotros como consecuencia de unos precios no acordes con la situación económica actual”.
“Desafortunadamente, siguen siendo pocos los ensayos clínicos dirigidos a las personas que vivimos coinfectadas por VIH y VHC, a pesar de ser una población con una extrema urgencia de nuevas opciones terapéuticas”, declara Diego García. Según el presidente de FEAT, el esfuerzo y empeño que los activistas han puesto estos años ha sido fundamental para impulsar el desarrollo de estos nuevos fármacos, y considera que pronto se dispondrá de combinaciones con o sin interferón pegilado también en personas coinfectadas. “Esperemos que esta ventana abierta a la esperanza no se cierre para muchos de nosotros como consecuencia de unos precios no acordes con la situación económica actual”.
En la sesión dedicada a la coinfección por VIH y las hepatitis virales, se han presentado los resultados preliminares de seguridad y eficacia del uso de telaprevir o boceprevir en la práctica clínica, y del inhibidor de la proteasa del VHC en investigación simeprevir.
Terapia triple basada en telaprevir o boceprevir
Un grupo de investigación quiso evaluar la eficacia y la seguridad de los dos primeros inhibidores de la proteasa del VHC comercializados –telaprevir y boceprevir– combinados con interferón pegilado y ribavirina en una cohorte de pacientes coinfectados.
Este estudio multicéntrico y retrospectivo incluyó a pacientes con genotipo 1 del VHC de centros hospitalarios de Alemania y España que habían recibido terapia triple contra la hepatitis C entre 2012 y 2013. Los investigadores han hecho públicos los resultados preliminares de eficacia y seguridad a la semana 24, evaluando asimismo la respuesta al tratamiento a las semanas 4, 8 y 12.
Se inscribió a un total de 146 pacientes procedentes de 20 centros hospitalarios (12 alemanes y 8 españoles), con una mediana de edad de 48 años (rango intercuartil [RIC]: 43 – 51); la amplía mayoría eran varones (84%); y un 60% referían una historia de uso de drogas inyectables. Por lo que respecta a la infección por VIH, los pacientes tenían en su mayoría la carga viral indetectable (92%), presentando un recuento mediano de CD4 basal de 558 células/mm3 (RIC: 384-716). Un 72% de los pacientes estaban tomando la pareja de análogos de nucleósido tenofovir/emtricitabina (Truvada®) y, como tercer fármaco de la combinación, un 50% estaban recibiendo el inhibidor de la integrasa raltegravir (Isentress®), una pauta antirretroviral recomendada en el contexto de la coinfección para evitar potenciales interacciones con telaprevir o boceprevir.
A priori, los pacientes tenían un perfil menos proclive a responder al tratamiento: un 61,2% estaban infectados por el subtipo 1a (que responde peor al tratamiento) y casi un 70,5% tenían los polimorfismos desfavorables (CT o TT) en el gen IL28B, lo que predispone también a una peor respuesta a interferón pegilado. Antes de empezar la terapia triple, la mediana de la carga viral de los participantes fue de 6,24 log10 (RIC: 5,75 – 6,60) y una proporción elevada de éstos (42,4%) tenían ya cirrosis hepática (F4 >12,5 kilopascales [kPa]).
En cuanto a la historia de tratamiento contra la hepatitis C, un 22% nunca habían sido tratados con anterioridad; un 24% eran pacientes pretratados recidivantes (es decir, su carga viral fue indetectable al finalizar un tratamiento previo contra el VHC, pero volvió a ser detectable antes de transcurrir los seis meses); y un 40% eran respondedores nulos a un tratamiento anterior contra la hepatitis C. Telaprevir fue el inhibidor de la proteasa del VHC utilizado por la mayoría de los pacientes de esta cohorte (82%).
Los resultados muestran que las tasas de participantes coinfectados con carga viral del VHC indetectable en los diferentes momentos de análisis del estudio son prácticamente similares a las observadas en pacientes monoinfectados por VHC tratados con terapia triple: 62% (84/135) a la semana 4; 79% (68/86) a la semana 8; 81% (104/128) a la semana 12; y 75% (71/95) a la semana 24.
De forma semejante a los resultados obtenidos en estudios efectuados en pacientes monoinfectados, los pacientes coinfectados con cirrosis tuvieron tasas de respuesta al tratamiento más reducidas que los participantes coinfectados que no tenían cirrosis: 74% (39/53) frente a 86% (63/73) a la semana 12; y 64% (27/42) frente a 83% (43/52) a la semana 24.
No se apreciaron diferencias significativas en la respuesta al tratamiento de acuerdo con la pauta de tratamiento antirretroviral tomada por los participantes.
Solo dos pacientes tuvieron que interrumpir la terapia triple como consecuencia de los efectos secundarios y, lamentablemente, un paciente falleció a causa de una descompensación hepática grave.
Hasta la semana 24, trece pacientes fueron no respondedores al tratamiento, siete pacientes experimentaron un rebote viral y dos desarrollaron la mutación V36M, que confiere resistencia a los inhibidores de la proteasa del VHC, y un paciente se perdió durante el seguimiento.
A la espera de los resultados definitivos del estudio (análisis a las 48 semanas -respuesta de fin del tratamiento- y 24 semanas después de haber finalizado el tratamiento -respuesta virológica sostenida-), los investigadores concluyen que, en este estudio, se observa un elevada tasa de respuesta inicial al tratamiento y una baja tasa de interrupciones como consecuencia de los efectos secundarios. Con todo, los investigadores muestran cautela frente a la descompensación hepática que, aunque en su estudio fue poco habitual, supone una complicación grave en pacientes cirróticos.
Simeprevir
Simeprevir es un inhibidor de la proteasa NS3/4A en avanzado estado de desarrollo para el tratamiento de la infección crónica por VHC. Este fármaco oral, de una sola toma diaria en un único comprimido, presenta actividad frente a los genotipos 1, 2, 4, 5 y 6 del VHC, y muestra un perfil de seguridad favorable. Este inhibidor de la proteasa está siendo investigado en combinaciones tanto con interferón pegilado como sin él.
El estudio C212 es un ensayo clínico abierto de fase III que evaluó la seguridad y la eficacia de simeprevir (frente a controles históricos) en personas coinfectadas por VHC de genotipo 1 y VIH. A los participantes se les administró simeprevir, a dosis de 150mg una vez al día, junto con interferón pegilado y ribavirina durante 12 semanas. Los pacientes naive y aquellos que habían presentado recidiva al finalizar un tratamiento previo (sin cirrosis en ninguno de los dos casos) siguieron terapia guiada por la respuesta con interferón pegilado y ribavirina hasta las 24 o 48 semanas. El resto de participantes (respondedores nulos, respondedores parciales y/o pacientes con cirrosis) recibieron interferón pegilado y ribavirina hasta la semana 48.
Los investigadores han dado a conocer los resultados preliminares basados en la tasa de respuesta virológica sostenida a las 12 semanas de finalizar el tratamiento (RVS12) con la terapia triple (simeprevir, interferón pegilado y ribavirina).
Un total de 106 participantes fueron incluidos en el estudio y tratados, de los que 93 estaban tomando tratamiento antirretroviral. Las tasas de RVS12 fueron del 79,2% entre pacientes naive; del 57,2% en aquellas con respuesta nula a un tratamiento previo (p <0,001, en ambos casos, respecto a controles históricos, según un análisis por intención de tratamiento); del 86,7% en recidivantes; y del 70,0% en respondedores parciales (véase tabla más abajo).
Un 89% de los pacientes naive y recidivantes a un tratamiento previo cumplieron los criterios para la terapia guiada por la respuesta y pudieron acortar la duración de la terapia hasta la semana 24; el 87% (47/54) de estos pacientes habían alcanzado la RVS12. Las tasas de RVS12 fueron altas independientemente del estadio de fibrosis hepática basal de los pacientes de acuerdo con la puntuación en la escala Metavir: se observaron unas tasas globales de RVS12 de un 80,0% y de un 63,6% en pacientes que tenían un estadio de fibrosis F0-F2 y F3-F4, respectivamente, aunque conviene señalar que los subgrupos eran pequeños, como puede apreciarse en la tabla siguiente:
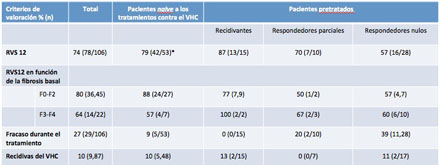
Hasta la semana 12, los efectos secundarios más habituales fueron aquellos que a menudo se asocian con el uso de interferón pegilado (fatiga, dolor de cabeza, náuseas, neutropenia y anemia). La mayor parte de los acontecimientos adversos fueron de grados 1 o 2. El 5,7% de los participantes experimentaron efectos adversos graves, ninguno de los cuales provocó la muerte.
En sus conclusiones, los investigadores indican que simeprevir fue, en general, bien tolerado, con unos niveles de seguridad semejantes a los mostrados en estudios realizados en personas sin VIH, y con unas tasas de RVS12 elevadas en pacientes coinfectados por VIH naive a los tratamientos contra el VHC, respondedores nulos, parciales o recidivantes a un tratamiento previo contra la hepatitis C.
Fuente: Elaboración propia.
Referencias: Munteanu DI, Neukam K, Rivero A, et al. Efficacy of DAAs Based HCV Triple Therapy in HIV-HCV Coinfected Patients: Interim 24-week Results: Interim 24-week Results. 14th European AIDS Conference (EACS 2013). October 16-19, 2013. Brussels. Abstract PS9/3.
Dieterich D, Rockstroh J, Orkin C, et al. Simeprevir (TMC435) with Peginterferon/Ribavirin in patients Co-infected with HCV genotype-1 and HIV-1: Primary analysis of the C212 Study. 14th European AIDS Conference (EACS 2013). October 16-19, 2013. Brussels. Abstract LBS9/5.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







