El fármaco no resulta eficaz en personas que incluyen atazanavir potenciado por ritonavir en su pauta antirretroviral
Tras los resultados a doce semanas de un estudio de fase II que evaluaba el uso de telaprevir (Incivek™; Incivo® en Europa) en coinfectados por VIH y el virus de la hepatitis C (VHC), presentados en la XVIII Conferencia sobre Retrovirus e Infecciones Oportunistas (CROI), celebrada en el mes de marzo en Boston (EE UU) (véase La Noticia del Día 03/03/2011), los resultados a 24 semanas del mismo estudio, presentados en el 62 Encuentro Anual de la Asociación Americana para el Estudio de las Enfermedades Hepáticas (AASLD, en sus siglas en inglés), muestran nuevas características del fármaco en la población coinfectada.
El estudio en cuestión está formado por dos partes. Mientras que en la parte A se incluyó a 13 personas coinfectadas por VIH y VHC que no tomaban terapia antirretroviral (TARV), en la Parte B se incluyó a coinfectados que sí tomaban terapia anti-VIH. Todos los participantes tenían VHC de genotipo 1 y fueron distribuidos aleatoriamente a recibir 12 semanas de tratamiento con telaprevir, interferón pegilado y ribavirina seguidas por 36 con únicamente interferón pegilado y ribavirina, o 48 semanas de interferón pegilado, ribavirina y placebo. La dosis estándar de telaprevir es de 750mg tres veces al día, pero, debido a una interacción, en personas que toman efavirenz (Sustiva®; también en Atripla®) la dosis es de 1.125mg tres veces al día.
El presente análisis interino incluyó a los 44 participantes que habían llegado a la semana 24 de tratamiento, cuyos resultados de eficacia –porcentaje de participantes con carga viral indetectable del VHC en cada intervalo de tiempo– pueden observarse en la siguiente tabla:
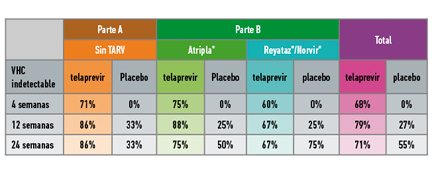
Los resultados muestran que el uso de telaprevir mostró ostensiblemente mayor eficacia que la terapia estándar –formada por únicamente interferón pegilado y ribavirina- en personas que no tomaban TARV o tomaban la combinación efavirenz/tenofivir/emtricitabina (Atripla®). Sin embargo, en el caso de participantes que tomaban atazanavir (Reyataz®) potenciado por ritonavir (Norvir®), el porcentaje de personas con carga viral indetectable a las 24 semanas era inferior al del grupo con únicamente terapia estándar.
Los recuentos de CD4 tendieron a disminuir en todos los grupos del estudio, fenómeno frecuente en los tratamientos contra el VHC. Sin embargo, ello no produjo casos de rebrote viral.
En comparación con quienes tomaban terapia estándar, aquellos que incluyeron telaprevir en su tratamiento presentaron más casos de picores (39% y 9%, respectivamente), dolor de cabeza (37% y 27%, respectivamente), náuseas (34% y 23%, respectivamente), exantema cutáneo (34% y 23%, respectivamente), fiebre (21% y 9%, respectivamente) y depresión (21% y 9%, respectivamente). En cambio, lo casos de pérdida de peso fueron más frecuentes en el grupo con terapia estándar (11% y 23%, respectivamente).
Para adquirir mayores conocimientos relativos al uso de telaprevir en coinfectados, la compañía propietaria de la molécula planea iniciar próximamente un estudio de fase III en el que la duración del tratamiento sea guiada por la respuesta de cada participante. Es de esperar que en dicho estudio de fase III, o a través de posteriores ensayos, queden ya claramente definidas las combinaciones de antirretrovirales que pueden ser tomadas mientras se realiza un tratamiento contra la hepatitis C basado en telaprevir.
Fuente: Aidsmeds / HIVandHepatitis.
Referencia: Sherman KE, Rockstroh JK, Dieterich DT, et al. Telaprevir Combination with Peginterferon Alfa-2a/Ribavirin in HCV/HIV Coinfected Patients: 24-Week Treatment Interim Analysis. 62nd Annual Meeting of the American Association for the Study of Liver Disease (AASLD 2011). San Francisco, November 4-8. 2011. Abstract LB-8.










