La compañía farmacéutica AbbVie ha anunciado la finalización de los ensayos clínicos de fase III con su combinación de fármacos contra el virus de la hepatitis C (VHC) de genotipo 1, formada por el inhibidor de la proteasa ABT-450, el inhibidor del complejo de replicación NS5A ABT-267 y el inhibidor de la polimerasa no análogo de nucleósido ABT-333, todo ello administrado con o sin ribavirina.
Los ensayos clínicos de fase III con dicha combinación han abarcado un total de 25 países y más de 2.000 participantes. En la carrera hacia la aprobación que han emprendido las compañías farmacéuticas con sus antivirales de acción directa frente al VHC de segunda generación, la especialización, es decir, hallar un grupo de personas con VHC para las cuales el fármaco sea especialmente beneficioso, puede ser un importante valor añadido para el éxito de estos fármacos.
En este sentido, la combinación de AbbVie solo se ha ensayado contra el VHC de genotipo 1 –algo frecuente entre aquellas combinaciones que incluyen inhibidores de la proteasa, que tienden a tener una acción exclusiva frente a este genotipo-. Aunque este hecho podría contemplarse como una limitación, los prácticamente inmejorables resultados mostrados por la presente combinación en los estudios de fase III podrían convertirla, una vez aprobada, en la combinación preferente para personas con VHC de genotipo 1.
Los resultados de eficacia –índices de respuesta virológica sostenida a las 12 semanas (RVS12),prácticamente sinónimo de curación- de los diversos estudios se resumen en la siguiente tabla:
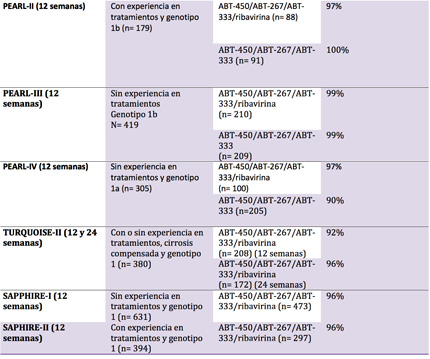
Los imponentes niveles de eficacia son especialmente llamativos en aquellos subgrupos de personas con VHC con menor tendencia a buenos niveles de respuesta –como son los infectados por VHC de subtipo 1a o aquellos con cirrosis hepática-, en los que la combinación evaluada logra tasas de RVS12 superiores al 90%, del mismo modo que en el resto de participantes.
La compañía farmacéutica manifestó que el resto de resultados de los estudios –entre los que cabe destacar los relativos a su tolerabilidad- se irán publicando a lo largo del año en diversas conferencias internacionales.
El buen posicionamiento en el tratamiento del VHC de genotipo 1 que la combinación ABT-450/ABT-333/ABT-267, a la luz de los presentes ensayos clínicos de fase III, obtendría al lograr la aprobación solo podría verse ensombrecido por cuestiones económicas. Así, es de esperar que, ante la llegada de numerosos antivirales de acción directa de segunda generación, todos ellos capaces de obtener elevadas tasas de eficacia, el precio al cual salgan al mercado sea un condicionante importante de su prescripción (especialmente en países, como España, con cofinanciación pública).
Por ello, la moderación de las compañías farmacéuticas a la hora de negociar el precio de sus medicamentos con las autoridades sanitarias será esencial para asegurar el acceso del mayor número de personas a tratamientos que, como el de AbbVie, son de corta duración, elevada eficacia, buena tolerabilidad y, lo que es más importante, mejoran claramente las opciones terapéuticas actuales. Sería realmente lamentable que por motivos económicos –algo que ya ha sucedido en el pasado- buenos fármacos acaben quedándose en las estanterías de los almacenes de las compañías farmacéuticas y que solo puedan ser utilizados por aquellas personas (una minoría) que puedan asumir su importe.
Fuente: HIVandHepatitis / Elaboración propia (gTt-VIH).
Referencia: Comunicado de prensa de AbbVie 04/02/2014.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







