De un total de 178 participantes con VIH multirresistente que empezaron a tomar un tratamiento con el fármaco experimental raltegravir, algo más de la mitad consiguió y mantuvo carga viral indetectable después de 48 semanas. Se trata del protocolo 005, un ensayo de Fase II que la compañía Merck está llevando a cabo como parte del desarrollo del que al parecer va a ser el primer antirretroviral de la clase de los inhibidores de la integrasa.
Estos resultados han sido presentados en la reciente 47 Conferencia Interciencias sobre Agentes Antimicrobianos y Quimioterapia (ICAAC) celebrada en Chicago (EE UU) el pasado mes de septiembre. Se trata de un ensayo multicéntrico (con la participación de hospitales europeos, norte y suramericanos) con reparto aleatorio y doble ciego, que experimenta con tres dosis distintas de raltegravir (también conocido como MK-0518) para evaluar su seguridad y eficacia frente a placebo.
Para participar en este ensayo, entre otros requisitos, había que tener una carga viral por encima de las 5.000 copias/mL y VIH con resistencia documentada a tres clases de antirretrovirales orales. A cada persona se le diseñó una terapia de base optimizada (TBO) y se asignó aleatoriamente a un grupo para recibir 200mg de raltegravir dos veces al día; 400mg de raltegravir dos veces al día; 600mg de raltegravir también dos veces al día; o placebo.
Después de al menos 24 semanas de tratamiento y una vez seleccionada la dosis de 400mg dos veces al día para la Fase III, todos los participantes en el estudio, incluidos aquellos que estaban en el brazo con placebo, pasaron a tomar esta dosis, con lo que el protocolo pasó a ser un ensayo abierto. Así, los resultados presentados corresponden a ambos periodos, el doble ciego y el abierto.
Estos 178 pacientes, de los que se han dado a conocer resultados, habían estado previamente tomando antirretrovirales durante una mediana de 9 años y presentaban al inicio del estudio una mediana de carga viral de 4,7log10. El descenso medio de carga viral osciló entre 1,55 y 1,64 log10 frente a 0,28 log10 del grupo que tomó placebo. Éstos son otros resultados de eficacia: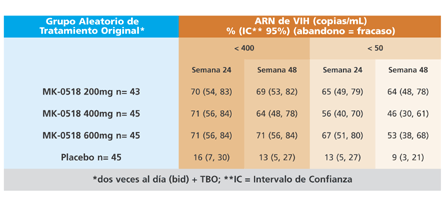
En general, a la semana 48, el 54% de las personas que tomaba raltegravir tenía cargas virales por debajo de 50 células/mL. Las mutaciones en la integrasa que se observaron en los virus de los participantes que experimentaron fracaso virológico fueron N155 o Q148 junto a otras adicionales.
Según los investigadores, raltegravir fue bien tolerado y los efectos secundarios observados fueron similares a los del brazo con placebo. Entre los 133 pacientes que tomaron raltegravir, dos tuvieron elevaciones de la transaminasa AST de grado 3 y uno de ALT. Hubo una pancreatitis aguda, tras sólo dos dosis, que se atribuyó al TBO. Una acidosis metabólica con insuficiencia renal desembocó en sepsis y muerte de un paciente del brazo de 600mg. Tres personas más abandonaron el estudio por toxicidad: una en el grupo placebo a causa de la lipoatrofia, y otras dos del grupo de 200mg por elevaciones de AST y ALT.
Estos datos avalan la continuación del desarrollo de este nuevo antirretroviral especialmente en personas con virus resistentes. Se prevé que en Estados Unidos se apruebe en las próximas semanas. En Europa no será hasta bien entrado 2008 cuando tengamos noticias sobre su aprobación. Mientras, está disponible bajo un programa de acceso expandido en unos 25 hospitales españoles. También se puede acceder en caso necesario por uso compasivo, un procedimiento mediante el cual el médico tramita una solicitud de fármaco para cada paciente en particular.
Fuente: Elaboración propia.
Referencia: B. Grinsztejn, B. Nguyen, C. Katlama, J. Gatell. 48 Week Efficacy and Safety of MK-0518, a Novel HIV-1 Integrase Inhibitor, in Patients with Triple-Class Resistant Virus. 47 ICAAC, Septiembre 2007. Abstract H-713.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







