Según los resultados de dos estudios presentados en el Encuentro de la Asociación Americana para el Estudio de las Enfermedades Hepáticas (AASLD, en sus siglas en inglés), el tratamiento con el inhibidor de la proteasa NS3/4A del virus de la hepatitis C (VHC) TMC435, junto a interferón pegilado y ribavirina, sería capaz de proporcionar tasas elevadas de respuesta virológica sostenida (RVS) en personas con VHC de genotipo 1 con o sin experiencia en el uso de tratamientos contra la hepatitis C.
El primero de los estudios, de fase IIb y conocido como PILLAR, contó con la participación de 386 personas monoinfectadas por el VHC sin experiencia en tratamientos.
El 55% de los participantes eran hombres, su práctica totalidad de etnia blanca, con una mediana de la edad de 46 años y unas tasas de fibrosis avanzada (estadio F3) de entre el 9 y el 23% según los grupos. El rango de participantes con perfil genético favorable a la respuesta (portadores del genotipo CC del gen IL28B) se movió entre el 22 y el 40%.
Los participantes fueron distribuidos aleatoriamente a recibir 75 o 150mg de TMC435 una vez al día durante 12 o 24 semanas junto al tratamiento estándar (formado por interferón pegilado y ribavirina). Por medio de una estrategia guiada por la respuesta temprana al tratamiento, aquellos participantes con carga viral del VHC inferior a 25 UI/mL (incuantificable) a la semana 4 y carga viral indetectable entre las semanas 12 y 20 podían interrumpir el tratamiento a la semana 24, mientras que el resto seguían tomando tratamiento estándar sin el fármaco experimental hasta la semana 48. Los resultados se compararon con los de un grupo control que siguió el tratamiento estándar (sin TMC435) durante 48 semanas.
Los resultados de los diferentes brazos del estudio se resumen en la siguiente tabla:
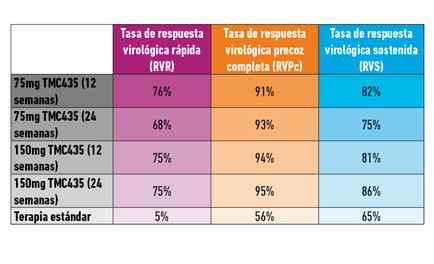
Alrededor del 80% de los participantes de los cuatro grupos con TMC435 cumplieron los criterios para reducir el tratamiento a 24 semanas (porcentaje bastante uniforme en todos los grupos). Entre quienes cumplieron dichos criterios, las tasas de RVS fueron de entre el 85 y el 96% y las de recidiva se movieron entre el 8 y el 19%.
En los grupos con dosis de 75mg de TMC435 y VHC de subtipo 1b, las tasas de RVS fueron superiores a las de personas con la misma dosis pero subtipo 1a (fenómeno no observado en los grupos con dosis de 150mg).
Los efectos adversos más comunes en todos los grupos estuvieron relacionados con el uso de interferón –síndrome pseudogripal-, por lo que los investigadores consideraron que TMC435 gozaba de buena tolerabilidad. En algunas personas que tomaron dosis de 150mg diarios de TMC435 se observaron elevaciones transitorias de los niveles de bilirrubina.
La eficacia del nuevo fármaco fue independiente del genotipo del gen IL28B, lo cual suavizaría el impacto del polimorfismo sobre la respuesta al tratamiento estándar.
La segunda presentación con TMC435 proporcionó los resultados finales del estudio ASPIRE, que confirmaron la buena tendencia mostrada en el análisis preliminar (véase La Noticia del Día 27/06/2011).
En ASPIRE, TMC435 se administró junto al tratamiento estándar en 462 personas con VHC de genotipo 1 en las que había fracasado un tratamiento previo con interferón pegilado y ribavirina.
El estudio distribuyó aleatoriamente a los participantes en 6 brazos con TMC435 (100 o 150mg durante 12, 24 o 48 semanas, junto, en todos los grupos, a 48 semanas de tratamiento estándar) y un brazo con placebo y tratamiento estándar.
Las tasas de RVS en función de la respuesta al tratamiento previo son las descritas en la siguiente tabla:
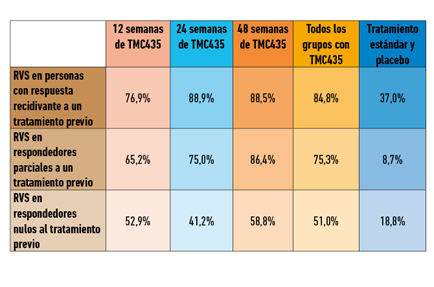
Los resultados de ambos estudios muestran que TMC435 incrementa de forma significativa las tasas de respuesta en comparación con la terapia estándar. En ambos estudios el fármaco mostró una buena tolerabilidad, lo que podría constituir, ante la inminente llegada al mercado de muchos fármacos anti-VHC, uno de los puntos a favor del uso de TMC435, aunque será necesario verificar que las elevaciones en los niveles de bilirrubina observadas sean realmente transitorias y no se trate de un indicador de toxicidad que pudiera generar consecuencias negativas a largo plazo.
Fuentes: HIVandHepatitis / Aidsmeds.
Referencias: M Fried, M Buti, GJ Dore, et al. TMC435 in Combination with Peginterferon and Ribavirin in Treatment-Naive HCV Genotype 1 Patients: Final Analysis of the PILLAR Phase IIb Study. 62nd Annual Meeting of the American Association for the Study of Liver Diseases (AASLD 2011). San Francisco, November 4-8. 2011. Abstract LB-5.
Medivir AB. Medivir Announces Final Results from TMC435 Phase IIb ASPIRE (C206) Study. Press release. November 2, 2011.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







