Las personas que inician tratamiento antirretroviral con el inhibidor de la proteasa lopinavir/ritonavir (Kaletra®) pueden tomar los comprimidos una o dos veces al día con seguridad y consiguiendo una eficacia similar.
Ésta es la principal conclusión del estudio M05-730 que durante 96 semanas siguió prospectivamente a 664 pacientes que fueron repartidos aleatoriamente para tomar lopinavir/r 800/200mg una vez al día (QD) junto a tenofovir/emtricitabina (Truvada®) o lopinavir/r 400/100mg dos veces al día (BID) también junto tenofovir/emtricitabina.
Durante las 8 primeras semanas, el estudio tuvo cuatro brazos, puesto que por cada dosificación hubo dos grupos: uno tomaba lopinavir/r en la antigua formulación de cápsula blanda y otro grupo tomaba el comprimido de uso actual. Tras este periodo, todos los participantes pasaron a tomar lopinavir/r en comprimidos hasta el final de estudio.
Los porcentajes de mujeres que se inscribieron en el ensayo fueron del 20% y 23%, en los grupos QD y BID, respectivamente. En general el 78% y el 72% de participantes, respectivamente, fueron blancos. Las personas negras fueron un 17% y un 19%, respectivamente.
La mediana de edad al empezar, similar en ambos grupos, era de unos 39 años con un rango de 19 a 71 años. La mediana de carga viral, de unos 5log10. En los grupos QD y BID, respectivamente, un 48% y un 58% tenían carga viral alta (≥100.000 copias/mL). La mediana de CD4 al inicio era de 216 y 215 células/mm3, respectivamente.
Aquéllos que comenzaron el estudio con recuentos inferiores a 50 células/mm3 fueron el 10% en el brazo QD y el 16% en el BID. Y los que tenía recuentos iguales o superiores a 200 CD4 fueron el 55% del total en el grupo QD y el 54% en el BID.
Durante las 96 semanas que duró el estudio un total de 77 participantes de cada brazo (23%) abandonó el estudio. El fracaso del tratamiento fue el responsable en el 2,1% (n=7) y 2,7% (n=9) de los casos en los grupos QD y BID, respectivamente. Mayor fue la tasa de abandonos por efectos secundarios o eventos relacionados con el VIH 6% y 4,8%, respectivamente. El resto, un 15%, en ambos grupos, se debió a factores personales tales como pérdida en el seguimiento, retirada del consentimiento, falta de adhesión, etc.
Según el análisis de intención de tratamiento, en el que los participantes que abandonan se cuentan como fracaso, al cabo de 96 semanas de tratamiento, un total de 216 pacientes en el grupo QD (64,9%) y 229 en el grupo BID (69,2%) [p=0,249] tenían carga viral indetectable (ARN de VIH <50 copias/mL). La diferencia media (Intervalo de confianza 95%) fue de -4,3% (-11,5%, 2,8%), lo que muestra no inferioridad del grupo QD en comparación con el BID, según el margen preestablecido de no inferioridad (-12%).
El análisis en tratamiento, que sólo cuenta aquellas persona que completaron el estudio, los porcentajes de eficacia fueron del 87,4% y 92,3% en los brazos QD y BID, respectivamente. Los resultados son similares puesto que la diferencia no es estadísticamente significativa (p=0,075).
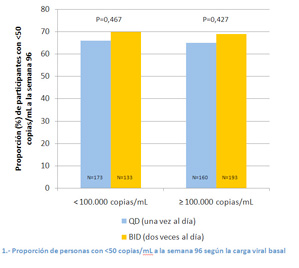 Como se puede ver en el gráfico 1, la eficacia también fue similar entre aquéllos que empezaron con cargas virales por debajo de 100.000 copias/mL y entre los que lo hicieron con cargas virales más altas.
Como se puede ver en el gráfico 1, la eficacia también fue similar entre aquéllos que empezaron con cargas virales por debajo de 100.000 copias/mL y entre los que lo hicieron con cargas virales más altas.
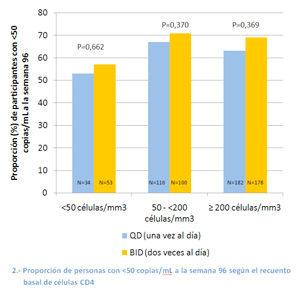 Como muestra el gráfico 2, los porcentajes de participantes que alcanzaron carga viral indetectable también fueron similares entre los que empezaron el estudio con recuentos de CD4 inferiores a 50, de 50 a <200 y con ≥200 células/mm3.
Como muestra el gráfico 2, los porcentajes de participantes que alcanzaron carga viral indetectable también fueron similares entre los que empezaron el estudio con recuentos de CD4 inferiores a 50, de 50 a <200 y con ≥200 células/mm3.
Los incrementos de CD4 fueron también similares +234,8 células/mm3 en el grupo QD y +254 células/mm3 en el grupo BID (p=0,269).
En cuanto a la seguridad, los efectos secundarios (de moderados a graves) más frecuentes fueron diarrea (17,7% y 16%, en los grupos QD y BID, respectivamente), náusea (7,5% y 5,4%, respectivamente), vómitos (3,3% y 4,2%, respectivamente) y fatiga (2,1% y 1,5%, respectivamente).
En cuanto a las anomalías de laboratorio, los aumentos medios de triglicéridos y colesterol no-HDL fueron ligeramente inferiores en el grupo QD y el descenso medio en el cociente LDL/HDL fue un poco mayor en este grupo.
Las elevaciones de las enzimas hepáticas de grado 3-4 fueron en general poco frecuentes, con algunos casos más en el grupo BID. Las de aspartato aminotransferasa (AST) se dieron en el 1,8% y 3,4% de participantes en los brazos QD y BID, respectivamente; y los de alanina animontrasferasa (ALT) en el 2,1% y 2,8%, respectivamente.
En general la emergencia de mutaciones de resistencia fue poco frecuente y similar en ambos grupos del estudio. Se detectó la mutación M184V que confiere resistencia a emtricitabina y lamivudina, pero no se vieron mutaciones que confirieran resistencia ni a tenofovir ni a los inhibidores de la proteasa.
Se trata del estudio más amplio y con mayor duración que ha comparado la dosificación de Kaletra® en forma de comprimido una o dos veces al día en pacientes sin experiencia previa en tratamientos, y al igual que otros ensayos anteriores confirma la viabilidad de empezar el tratamiento antirretroviral con Kaletra® y Truvada® una vez al día.
Fuente: Elaboración propia
Referencia: J.G.García, D.Cohen, M Johnson et al. Comparable safety and efficacy with once-daily (QD) versus twice-daily (BID) doping of lopinavir/ritonavir (LPV/r) tablets with emtricitabine (FTC) + tenofovir (TDF) in antirretroviral (ARV)-naïve HIV-1 infected subjects: 96-week results of the randomized trial M05-730. 5th IAS Conference on HIV Pathogenesis, Treatment and Prevention. July 19-22, 2009, Cape Town. Poster MOPEB035.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







