La Comisión Europea ha autorizado la ampliación de la indicación de daclatasvir (Daklinza®) para el tratamiento de la infección crónica por el virus de la hepatitis C (HVC) en tres nuevas poblaciones de pacientes. Así, ahora la nueva indicación, válida en los 28 estados miembro de la Unión Europea, autoriza el uso de daclatasvir más sofosbuvir (Sovaldi®) –acompañados o no de ribavirina, en función de la indicación clínica y el genotipo viral– para tratar el VHC en pacientes con cirrosis descompensada, coinfectados por el VIH-1 y en caso de recurrencia de la infección por el VHC tras un trasplante hepático.
Con anterioridad, ya estaba autorizado el uso de daclatasvir por la Comisión Europea para el tratamiento (en combinación con otros fármacos) de la infección crónica por los genotipos 1, 2, 3 y 4 del VHC en adultos. La combinación de daclatasvir y sofosbuvir constituye el único tratamiento oral de 12 semanas aprobado para el tratamiento de personas con el genotipo 3 del VHC sin cirrosis.
Las nuevas indicaciones de uso se basan en los resultados de los ensayos clínicos ALLY-1 y ALLY-2.
En las siguientes tablas se recogen las distintas recomendaciones en función de la población de pacientes (se incluyen las personas coinfectadas por el VIH):
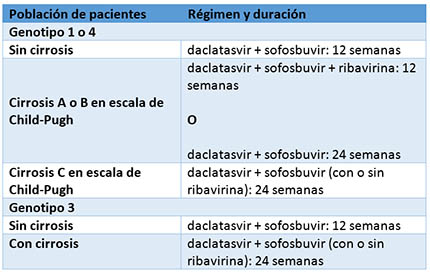
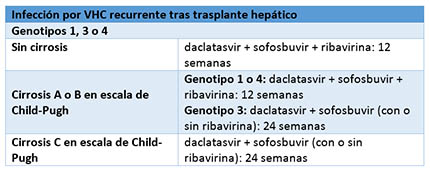
En el ensayo ALLY-1, un estudio abierto de fase 3, participaron 113 personas con infección crónica por el VHC con algún grado de cirrosis (60 personas) o que sufrieron una recurrencia de la infección tras un trasplante de hígado (53 personas). No se excluyó a ningún paciente por el genotipo del VHC. Estas personas recibieron daclatasvir más sofosbuvir junto con ribavirina durante 12 semanas.
En el ensayo, el 94% de los pacientes postrasplantados, y el 83% de los que tenían cirrosis, alcanzaron una respuesta virológica sostenida a la semana 12 (RVS12). Entre las personas con cirrosis, la tasa de RVS12 subió al 92-94% al considerar únicamente la cirrosis A o B en la escala Child-Pugh.
Cuatro de las personas con cirrosis tuvieron que someterse a un trasplante de hígado cuando ya habían empezado el tratamiento. Tres de ellas recibieron una extensión del tratamiento tras el trasplante, mientras que la cuarta persona (que ya había sido tratada durante 23 días antes del trasplante) no recibió una extensión del tratamiento. En los cuatro casos se alcanzó una RVS12.
No se registró ningún acontecimiento adverso de gravedad relacionado con la medicación, pero 16 pacientes dejaron de tomar los medicamentos del estudio debido a acontecimientos adversos. Así, 14 personas dejaron de tomar únicamente ribavirina y dos dejaron todo el tratamiento.
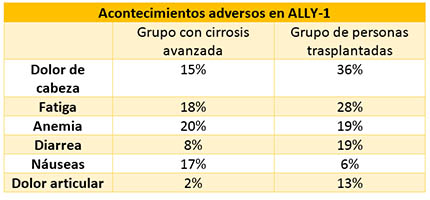
Salvo excepciones, los acontecimientos adversos en ALLY-1 fueron más frecuentes en el grupo de personas ya trasplantadas.
En lo que se refiere al ensayo ALLY-2, también se trata de un ensayo abierto de fase 3, en el cual, a 153 personas con hepatitis C crónica coinfectadas por el VIH (101 sin experiencia en tratamiento del VHC y 52 que sí habían recibido tratamiento con anterioridad) se les administró daclatasvir más sofosbuvir durante 12 semanas, mientras que 50 personas sin experiencia en tratamiento recibieron daclatasvir más sofosbuvir una vez al día durante 8 semanas.
En el brazo de 12 semanas de tratamiento, el régimen probado consiguió una RVS12 del 97% (un 100% entre los pacientes infectados por el genotipo 3 del VHC). Las tasas de curación superaron el 94% en las personas con coinfectadas por el VIH que tomaban terapia antirretroviral. Las tasas disminuyeron, no obstante, hasta el 76% al reducir el tratamiento a ocho semanas (véase La Noticia del Día 12/03/15).
No se registraron acontecimientos adversos graves relacionados con el tratamiento, ni tampoco abandonos debido a los acontecimientos adversos. Los efectos secundarios del tratamiento fueron fatiga (17%), náuseas (13%) y dolor de cabeza (11%).
Fuente: Nota de Prensa de BMS/Elaboración propia (gTt-VIH)
Referencia: Nota de prensa de Bristol-Myers-Squibb (BMS) 28/01/2016: European Commission Approves Daklinza (daclatasvir) for the Treatment of Genotype 1, 3 and 4 Chronic Hepatitis C Patients with HIV Coinfection, Advanced Cirrhosis and Post-liver Transplant Recurrence of HCV
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







