La empresa farmacéutica Gilead ha anunciado recientemente que ha presentado una Solicitud de Nuevo Fármaco (NDA, en sus siglas en inglés) ante la Agencia para la Alimentación y el Medicamento de EE UU (FDA) para un comprimido que contiene una combinación de sofosbuvir (Sovaldi®) y velpatasvir. Sofosbuvir en un fármaco de la familia de los inhibidores de la polimerasa análogos de nucleótido, mientras que velpatasvir en un inhibidor del complejo de replicación NS5A. Esta combinación presenta actividad frente a los genotipos 1 al 6 del virus de la hepatitis C (VHC). No obstante, hay que recordar que se trata de un producto experimental y aún no se disponen de datos concluyentes sobre su seguridad y eficacia.
Los estudios de los que proceden los datos para la NDA se denominan ASTRAL-1, ASTRAL-2, ASTRAL-3 y ASTRAL-4 (véase tabla adjunta) y participaron sólo pacientes monoinfectados por el virus de la hepatitis C (VHC).

En el estudio ASTRAL-1, 116 personas recibieron placebo y del grupo de intervención 121 participantes (19%) presentaban cirrosis, al igual que 38 personas (14%) en el ASTRAL-2 y 163 (30%) en el ASTRAL-3. También hay que señalar que en el estudio ASTRAL-4 se evaluó el uso de sofosbuvir más velpatasvir (acompañados o no de ribavirina) durante 12 semanas y de sofosbuvir/velpatasvir durante 24 en personas con una cirrosis de clase B según la escala de Child-Pugh, con independencia del genotipo del VHC.
De las 1.035 personas tratadas con SOF/VEL en los estudios ASTRAL 1, 2 y 3, el 98% (1.015) alcanzaron el criterio de eficacia primario de alcanzar una respuesta virológica sostenida a la semana 12 (RVS12). De las 20 personas que no cumplieron este criterio, 13 experimentaron un fracaso virológico y las 7 restantes no completaron las visitas de seguimiento. Doce de los 13 fracasos virológicos se debieron a una recidiva (2 personas con el genotipo 1 y 10 con el genotipo 3) y hubo un caso de reinfección documentada. Ninguno de los participantes con genotipos 2, 4, 5 o 6 experimentó un fracaso virológico en estos estudios.
Las tasas de curación en los diferentes estudios fueron las siguientes (véase tabla):
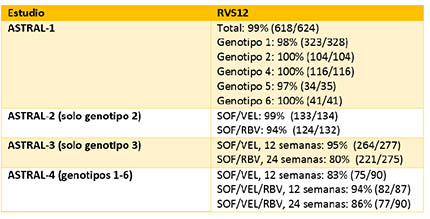
En ASTRAL-4, los participantes que recibieron SOF/VEL junto con ribavirina alcanzaron unas tasas de RVS12 más elevadas que las personas que sólo recibieron SOF/VEL (durante 12 o 24 semanas). Las tasas de curación con SOF/VEL+RBV durante 12 semanas alcanzaron el 96% en el caso de las personas con VHC de genotipo 1, y se quedaron en el 85% en el caso de las infectadas por el genotipo 3 del virus.
En cuanto a los efectos secundarios, los pacientes tratados con sofosbuvir/velpatasvir (SOF/VEL) durante doce semanas en los estudios ASTRAL-1, ASTRAL-2 y ASTRAL-3 presentaron una tasa similar de acontecimientos adversos en comparación con las personas tratadas con placebo en ASTRAL-1. Entre los efectos secundarios más habituales se contaron dolor de cabeza, fatiga y náuseas.
Los acontecimientos adversos más habituales en todos los brazos de ASTRAL-4 fueron fatiga, náuseas y dolor de cabeza. El 31% de las personas que recibieron la combinación que incluía ribavirina presentaron anemia, un efecto secundario que solo se registró en el 4% de las personas tratadas con SOF/VEL durante 12 semanas y en el 3% de las tratadas 24 semanas. Se tuvo que tratar de forma urgente los acontecimientos graves en el 18% de los participantes y se registraron 9 fallecimientos. La mayor parte de estos acontecimientos graves y muertes estuvieron ligados a una enfermedad hepática avanzada.
Los resultados de estos estudios demuestran que una terapia de 12 semanas con la combinación SOF/VEL ofrece unas elevadas tasas de curación para todos los genotipos del VHC.
La FDA ha asignado a esta combinación una designación de ‘Terapia Innovadora’, categoría que este órgano regulador reserva a los medicamentos experimentales que pueden ofrecer una importante ventaja respecto a las opciones de tratamiento existentes. De todos modos, también hay que apuntar que al ser un producto en fase de investigación, aún no se dispone de datos concluyentes sobre seguridad y eficacia.
Gilead planea presentar una solicitud de regulación para la aprobación de SOF/VEL en la Unión Europea antes de finalizar el año.
El promotor del ensayo está evaluando también el uso de esta nueva combinación a dosis fijas en un estudio en pacientes coinfectados por VIH y hepatitis C cuyos resultados se esperan hacer públicos en 2016.
Fuente: Comunicado de prensa de Gilead Sciences, Inc./Elaboración propia (gTt-VIH)
Referencia: Nota de Prensa 28/10/2015: Gilead Submits New Drug Application to U.S. Food and Drug Administration for Fixed-Dose Combination of Sofosbuvir/Velpatasvir for Treatment of All Six Genotypes of Hepatitis C
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







