Bristol-Myers Squibb anunció el pasado viernes 3 de mayo la aprobación, por parte de la Agencia de la Alimentación y el Medicamento de EE UU (FDA, en sus siglas en inglés), de la ampliación de la indicación de efavirenz (Sustiva®), que incluiría bebés y niños de entre tres meses y tres años con un mínimo de 3,5kg de peso. Los cambios también afectarían a la posología, ya que se permite abrir las cápsulas en aquellos casos en los que no se puedan ingerir.
Hasta la fecha, la indicación de efavirenz abarcaba el tratamiento antirretroviral a partir de los tres años y con un mínimo de 13kg de peso.
La presente aprobación se basa en los resultados de tres estudios abiertos que evaluaron las características farmacocinéticas, la seguridad y la eficacia antirretroviral del tratamiento con efavirenz –en combinación con otros antirretrovirales- en 182 participantes con o sin experiencia en tratamientos y edades comprendidas entre los tres meses y los 21 años. La mediana del seguimiento bajo tratamiento con efavirenz fue de 123 semanas. Los datos remitidos a la FDA mostraron respuesta virológica e inmunitaria en todos los grupos de edad.
Los acontecimientos adversos observados en los tres ensayos pediátricos fueron similares a los descritos en adultos, a excepción del exantema cutáneo, más habitual (32% de los niños lo experimentaron) y con una gravedad superior a la apreciada en adultos. El 2,7% de los niños incluidos en los estudios interrumpieron el tratamiento a causa del exantema cutáneo.
El uso de efavirenz en bebés menores de tres meses o con un peso inferior a los 3,5kg no ha sido aprobado, puesto que no ha sido evaluada su eficacia y seguridad en este subgrupo, que no fue incluido en los presentes tres estudios. Además, dado que no se ha investigado la dosis adecuada en estas personas, podría tener lugar el desarrollo de resistencias por dosis subóptima o efectos secundarios por dosis demasiado elevada.
En bebés o niños que no puedan ingerir las cápsulas, se permitirá abrir las cápsulas y vaciar su contenido en 1-2 cucharillas junto a una pequeña cantidad de alimento, o bien, si ello no es posible, mezclar el contenido de las cápsulas en leche maternizada.
Tras la presente aprobación por parte de la FDA, la dosificación de efavirenz en los países que se rigen por dicha agencia reguladora será la resumida en la siguiente tabla:
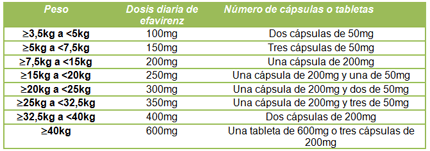
Esta aprobación supone una opción más en el tratamiento antirretroviral pediátrico, para el cual se dispone de muchas menos alternativas terapéuticas, especialmente en menores de tres años, donde suele disponerse de datos clínicos muy limitados.
Fuente: FDA / Elaboración propia.
Referencia: Comunicado de prensa de Bristol-Myers Squibb 03/05/2013.
Suscríbete a nuestros boletines
Utiliza este formulario para suscribirte a nuestros boletines. Si tienes cualquier problema ponte en contacto con nosotros.
Al continuar, confirmas que has leído el aviso legal y aceptas la política de privacidad.







