El medicamento estará disponible a partir del 1 de abril y es altamente eficaz frente al virus de la hepatitis C de genotipos 1, 3 y 4
La compañía farmacéutica Gilead Sciences ha anunciado la autorización, por parte del Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI), de precio y financiación para Harvoni® (combinación en un único comprimido de una sola toma diaria de sofosbuvir/ledipasvir). El nuevo medicamento permite el tratamiento de la infección por el virus de la hepatitis C de genotipos 1, 3 o 4 (solo o junto con ribavirina, siempre en terapias libres de interferón).
La presente decisión del MSSSI permitirá que, por un lado, el medicamento esté disponible para su dispensación en el Sistema Nacional de Salud a partir del 1 de abril y, además, que forme parte, junto a otros fármacos ya autorizados o de próxima autorización, de la estrategia terapéutica incluida en el Plan Estratégico para el Abordaje de la Hepatitis C en el Sistema Nacional de Salud, cuya ratificación definitiva se espera que se produzca el próximo 26 de marzo en el Consejo Interterritorial del Sistema Nacional de Salud, que se celebrará en Madrid.
En los estudios que permitieron su aprobación por parte de la Agencia Europea del Medicamento (EMA, en sus siglas en inglés) la combinación ha obtenido altas tasas de curación (véase La Noticia del Día 24/11/2014), que se mantienen incluso en personas con perfiles que, en anteriores terapias, dificultaban la respuesta, como por ejemplo aquellas con cirrosis hepática o las coinfectadas por VIH (véase La Noticia del Día 03/03/2015).
Las indicaciones para las que sofosbuvir/ledipasvir ha sido aprobado se resumen en la siguiente tabla:
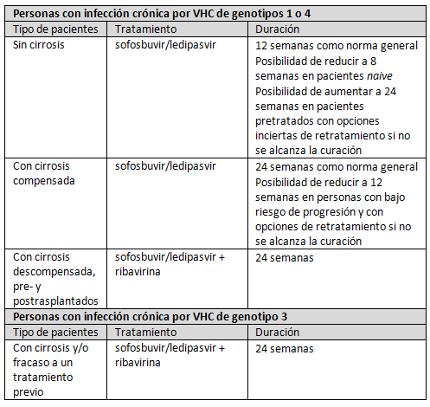
En cuanto al genotipo 2, añadir ledipasvir al tratamiento basado en ribavirina y sofosbuvir (Sovaldi®) no produciría beneficios clínicos de impacto suficiente como para contemplar su indicación clínica, ya que dicha combinación ya proporcionaría tasas de curación superiores al 90%.
Como en todos los nuevos medicamentos de acción directa frente al VHC, el punto más importante para favorecer el acceso a sofosbuvir/ledipasvir de los pacientes españoles será el precio al que finalmente salga al mercado. Un dato esperanzador es que, al contrario de lo ocurrido en el caso de sofosbuvir (Sovaldi®), donde la negociación del precio en España se prolongó 11 meses, la aprobación de la financiación pública de sofosbuvir/ledipasvir (Harvoni®) llega poco más de tres meses después de la aprobación por parte de la EMA.
Ello podría indicar una negociación del precio a la baja por parte de la compañía con el objeto de llegar a tiempo para entrar en los algoritmos terapéuticos incluidos en el Plan Estratégico para el Abordaje de la Hepatitis C en el Sistema Nacional de Salud.
El MSSSI ha cuantificado en 727 millones de euros el coste total de tratar a los 51.964 pacientes españoles en estadios F2, F3 y F4 (de un total de 95.524 personas diagnosticadas de infección crónica por VHC en España). Ello proporcionaría un coste promedio de alrededor de 14.000€ por paciente, muy inferior al que han salido al mercado la gran mayoría de los nuevos tratamientos. Este hecho solo podría compensarse con algún tipo de acuerdo de cupos o techo de gasto entre las autoridades sanitarias españolas y las compañías farmacéuticas propietarias de las patentes de dichos nuevos fármacos. Lamentablemente, la opacidad de los agentes públicos y privados respecto a este tipo de negociaciones dificulta enormemente hacer un análisis adecuado de la situación.
Fuente: Elaboración propia (gTt).
Referencia: Comunicado de prensa de Gilead Sciences 18/03/2015.










