El tratamiento podría reducirse a sólo 8 semanas en personas sin cirrosis hepática
Según los resultados del ensayo clínico de fase II LONESTAR, publicados en la edición del 8 de febrero de The Lancet, la combinación de sofosbuvir (Sovaldi®) y ledipasvir con o sin ribavirina podría obtener tasas de curación de entre el 95 y el 100% tanto en pacientes naive como en pretratados con genotipo 1 del virus de la hepatitis C (VHC).
La llegada de los antivirales de acción directa (fármacos que actúan directamente sobre las distintas fases de replicación del VHC) supuso un gran cambio en el paradigma de tratamiento de la hepatitis C. Hasta ese momento el tratamiento disponible se basaba en el uso únicamente de ribavirina e interferón pegilado que, a pesar de que durante mucho tiempo supuso la única esperanza de curación para muchas personas, presentaban una elevada carga de efectos secundarios (especialmente los atribuidos a interferón pegilado). Por este motivo, la gran esperanza en el ámbito del VHC es conseguir una combinación de antivirales de toma oral.
En el presente estudio, el régimen formado por sofosbuvir y ledipasvir se probó con y sin ribavirina durante 8 o 12 semanas en dos cohortes formadas por personas con genotipo 1 del VHC de un hospital de Texas (EE UU). La cohorte A incluyó a 60 personas sin experiencia en tratamientos y sin cirrosis hepática. La cohorte B incluyó a 40 personas, de las que el 55% tenía cirrosis hepática, que no habían alcanzado la curación tras un ciclo de tratamiento con terapia triple formada por interferón pegilado, ribavirina y boceprevir (Victrelis®) o telaprevir (Incivo®).
Dos tercios de los participantes eran hombres, casi el 10% de etnia negra y el promedio de la edad era de 50 años. La mayoría (cerca del 90%) presentaban el subtipo 1a del VHC (con menor respuesta al tratamiento que el 1b). Solo el 15% de los participantes tenía el genotipo CC de la interleuquina 28B (favorable a la respuesta al tratamiento).
En la cohorte A, los participantes fueron distribuidos aleatoriamente a recibir 8 semanas de tratamiento con una coformulación en un único comprimido de 400mg de sofosbuvir y 90mg de ledipasvir administrada junto con ribavirina (grupo 1); 8 semanas de la misma coformulación sin ribavirina (grupo 2); o 12 semanas de la coformulación sin ribavirina (grupo 3).
En la cohorte B, solo se distribuyó a los participantes en dos grupos: 12 semanas con coformulación sofosbuvir/ledipasvir y ribavirina o 12 semanas con únicamente sofosbuvir/ledipasvir.
El objetivo principal del estudio era determinar la tasa de respuesta virológica sostenida a las 12 semanas (RVS12, considerada, al uso, como la tasa de curación).
Los resultados de eficacia se resumen en la siguiente tabla:
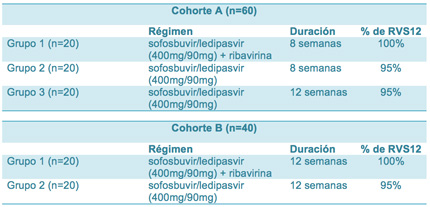
En la cohorte A, el 95% de las personas sin experiencia en tratamientos tratadas durante 8 o 12 semanas con sofosbuvir/ledipasvir alcanzaron RVS12. El porcentaje fue idéntico en ambos grupos.
En la misma cohorte, el 100% de quienes tomaron sofosbuvir/ledipasvir y ribavirina durante 8 semanas alcanzaron RVS12.
En la cohorte B, el 95% de las personas que tomaron sofosbuvir/ledipasvir sin ribavirina y el 100% de quienes tomaron los tres fármacos alcanzaron RVS12
Dos participantes (uno sin experiencia en tratamientos y otro con experiencia en tratamientos) experimentaron recidiva tras la finalización del tratamiento. Ambos tenían el subtipo 1a del VHC.
Sofosbuvir/ledipasvir fue una combinación, en general, bien tolerada, tanto junto a ribavirina como en biterapia.
Una persona que tomaba los tres fármacos experimentó anemia grave, que los investigadores relacionaron con ribavirina.
Los eventos adversos más comunes fueron náuseas, anemia, infecciones en las vías aéreas altas y dolor de cabeza.
Los resultados del presente estudio son prometedores, especialmente teniendo en cuenta las elevadas tasas de curación –prácticamente la totalidad de las personas tratadas- y el hecho de que en personas sin cirrosis hepática la combinación es eficaz con únicamente 8 semanas de terapia sin ribavirina. Además, factores típicamente relacionados con una peor respuesta tales como el genotipo de la IL28B o ser de etnia negra no parecieron afectar negativamente a los niveles de respuesta.
Tratamientos formados por ledipasvir/sofosbuvir, sin ribavirina y de ocho semanas de duración, podrían constituir una muy buena opción terapéutica en el marco del tratamiento de la infección por VHC de genotipo 1 para personas sin cirrosis hepática.
Es de esperar que en un período corto de tiempo lleguen numerosos tratamientos nuevos contra el VHC –especialmente frente al genotipo 1–, por lo que cualquier beneficio extra para el paciente, más allá de la eficacia (como, en este caso, la posibilidad de seguir un ciclo de tratamiento de solo ocho semanas y sin ribavirina), podría marcar la diferencia y decantar la opinión médica en favor de una opción terapéutica.
La semana pasada Gilead Sciences anunció que la compañía había presentado la solicitud de aprobación de la combinación a dosis fijas de sofosbuvir y ledipasvir para el tratamiento de la hepatitis C crónica en pacientes adultos con genotipo 1 tanto a la Agencia de la Alimentación y el Medicamento de EE UU (FDA, en sus siglas en inglés) como a la Agencia Europea de Medicamentos (EMA, en sus siglas en inglés) en ambos casos a través de procedimientos de revisión acelerada.
Fuente: HIVandHepatitis / Elaboración propia (gTt-VIH).
Referencia: Lawitz E, Poordad FF, Pang PS, et al. Sofosbuvir and ledipasvir fixed-dose combination with and without ribavirin in treatment-naive and previously treated patients with genotype 1 hepatitis C virus infection (LONESTAR): an open-label, randomised, phase 2 trial. The Lancet 383(9916):515-523. February 8, 2014.










