El fármaco es eficaz frente a cualquier genotipo del virus de la hepatitis C
La Agencia Europea del Medicamento (EMA, en sus siglas en inglés) ha autorizado la comercialización en los 28 países de la Unión Europea del inhibidor del complejo de replicación NS5a del virus de la hepatitis C (VHC) daclatasvir (Daklinza®).
El fármaco, el primero de esta familia terapéutica en ser aprobado, es activo frente al VHC de genotipos 1, 2, 3 y 4 y debe ser utilizado en combinación con otros antivirales. De forma destacable, el fármaco permite combinaciones libres de interferón pegilado y ribavirina con el ya aprobado por parte de la EMA –aunque aún en proceso de negociación del precio en España- sofosbuvir (Sovaldi®) y también las permitirá con el inhibidor de la proteasa del VHC en investigación asunaprevir una vez tenga lugar su aprobación (algo que ya ha tenido lugar en Japón).
Sobre la base de los estudios ya existentes en el momento de su publicación, las nuevas recomendaciones de tratamiento de la hepatitis C de la Asociación Europea para el Estudio del Hígado, presentadas el pasado mes de abril (véase La Noticia del Día 30/04/2014), ya contemplaban la utilización de daclatasvir junto a sofosbuvir (con o sin ribavirina) o con interferón pegilado y ribavirina. El hecho de incluir en las recomendaciones un fármaco todavía no aprobado indicaba su buen perfil, que ya hacia esperar una cercana aprobación.
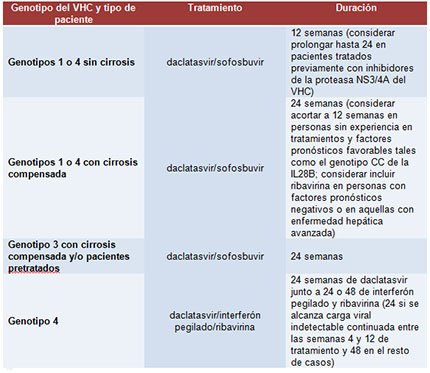
Entre los diferentes regímenes recomendados basados en daclatasvir, se incluyen las siguientes pautas:
La presente aprobación, a pesar de ser una muy buena noticia, genera cierta preocupación respecto al uso compasivo del fármaco, ya que cuando la EMA aprobó sofosbuvir (Sovaldi®), Gilead Sciences, compañía propietaria de dicho fármaco, dejó de proporcionarlo de forma gratuita dentro del ámbito del uso compasivo, algo que, de repetirse, podría dejar sin uso compasivo a personas que se encontraban en proceso de tramitación, algo frecuente en España dado el bloqueo que sufrió dicho programa hasta el pasado mes de junio (momento en el que se estableció la financiación del programa).
Puesto que la financiación del uso compasivo solo contempla pagar por sofosbuvir -hasta ahora BMS había proporcionado de forma gratuita el fármaco- cualquier cambio en la política de la compañía al respecto volvería a bloquear el programa de uso compasivo en España.
Otra incógnita relativa a daclatasvir es cuándo va a estar disponible en España, hecho que, a buen seguro, dependerá del proceso de negociación del precio, escollo que, por ejemplo, ha hecho que sofosbuvir –fármaco aprobado por la EMA meses atrás– todavía no esté disponible en España fuera de los procedimientos de uso compasivo.
Fuente: HIVandHepatitis / Elaboración propia (gTt-VIH).
Referencia: Comunicado de prensa de Bristol-Myers Squibb 27/08/2014.










