Esto podría explicar por qué está siendo tan complejo encontrar una vacuna contra el virus
Un equipo de investigadores del Instituto Tecnológico de California (Caltech) -EE UU- parece haber encontrado una razón que explica, al menos en parte, el motivo por el que los anticuerpos producidos por el organismo frente a la infección por VIH resultan ineficaces. Al parecer, las posibles dianas en la superficie del virus están muy separadas entre sí y el tamaño de los anticuerpos no les permite unirse a más de una de ellas al mismo tiempo, algo que limita su efectividad. Los hallazgos fueron publicados en la edición digital de Proceedings of the National Academy of Sciences (PNAS).
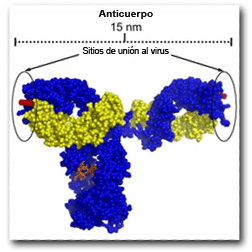 Los anticuerpos son proteínas en forma de ‘Y’ que se unen a los virus, neutralizándolos y evitando así que puedan infectar las células del organismo. Asimismo, tienen un mayor poder neutralizante cuando son capaces de unirse a las dianas virales con ambos brazos de la ‘Y’ más o menos a la vez.
Los anticuerpos son proteínas en forma de ‘Y’ que se unen a los virus, neutralizándolos y evitando así que puedan infectar las células del organismo. Asimismo, tienen un mayor poder neutralizante cuando son capaces de unirse a las dianas virales con ambos brazos de la ‘Y’ más o menos a la vez.
“Cuando los dos brazos del anticuerpo son capaces de unirse al mismo tiempo a un virus”, afirma Joshua Klein, un estudiante graduado en bioquímica y biofísica molecular en Caltech y coautor del documento publicado en PNAS, “puede producirse un aumento de entre cien y mil veces en la fuerza de la interacción, lo que en ocasiones se traduce en un incremento igualmente drástico de la capacidad de neutralización del virus. El uso de los dos brazos de los anticuerpos es el método empleado por la naturaleza para garantizar una sólida interacción en la unión [con el antígeno]”.
No obstante, en la práctica, esta unión de los dos brazos no resulta tan sencilla. En el caso del VIH, los anticuerpos tienen como dianas unas proteínas presentes en la superficie del virus que sobresalen de la membrana viral como una especie de lanzas o pinchos. Un anticuerpo sólo puede unirse a dos de estos ‘pinchos’ a la vez si están dentro de la distancia cubierta por los dos brazos de la ‘Y’.
Anticuerpos b12 y 4E10
En su informe, los investigadores analizaron las capacidades de neutralización de dos anticuerpos monoclonales aislados de personas con VIH. Uno, denominado b12, se une a una proteína conocida como gp120, que forma la parte superior de uno de los ‘pinchos’ del VIH. El otro, 4E10, se une a la proteína viral gp41, que se encuentra en la parte inferior del ‘pincho’, conocido como el tallo.
Los autores descompusieron estos anticuerpos en sus distintos componentes y compararon su capacidad para unirse y neutralizar el virus. Como cabía esperar, las versiones del anticuerpo b12 con un único brazo fueron menos eficaces en la neutralización del VIH que las que tenían dos brazos.
Sin embargo, en el caso del 4E10, tener dos brazos no supuso casi ninguna ventaja. Por otro lado, se descubrió que las versiones más grandes del 4E10 fueron menos eficaces que las más pequeñas en la neutralización del VIH. Estos resultados ponen de relieve los posibles obstáculos a los que podrían enfrentarse las vacunas diseñadas para inducir la producción de anticuerpos similares al 4E10.
No obstante, el b12 también tiene sus propios obstáculos que superar. De hecho, al examinar más detenidamente los datos del estudio, se comprobó que los beneficios de tener dos brazos (incluso en el caso de este anticuerpo b12) eran mucho menores que los observados en los anticuerpos dirigidos contra virus como el de la gripe. En otras palabras, los anticuerpos naturales del organismo contra el VIH son menos eficaces en la neutralización del virus de lo que cabría esperar.
Limitaciones intrínsecas
¿Qué explicación hay para esta menor eficacia observada? “La cosa empieza a ponerse realmente interesante cuando pensamos cuál es el aspecto que tiene el virus de la inmunodeficiencia humana”, afirma Klein. Mientras que la superficie del virus de la gripe cuenta con unos 450 ‘pinchos’, el VIH puede tener menos de 15, pese a que su tamaño es similar.
Con tan pocos ‘pinchos’ y tan alejados, resulta muy complicado encontrar dos que queden al alcance de un anticuerpo b12 o 4E10 (cuya longitud, generalmente, está entre los 12 y 15nm).
“Puede que el VIH haya evolucionado a fin de eludir una de las principales estrategias empleadas por nuestro sistema inmunitario para vencer a las infecciones”, afirma Klein. “De acuerdo con estos datos, parece que el virus está sorteando el efecto bivalente que es tan importante para que los anticuerpos sean potentes”.
El virólogo David Baltimore, profesor de biología y ganador de un premio Nobel de Medicina, afirma: “Creo que es un documento muy importante porque cambia el foco de debate respecto a por qué las respuestas de anticuerpos anti-VIH son tan pobres (…). Pone la atención en un aspecto conocido desde hace tiempo, pero a menudo olvidado, del ataque de los anticuerpos: que lo hacen con dos cabezas. Este documento muestra que los anticuerpos se ven obligados a emplear únicamente un extremo y esto hace que la unión sea menos fuerte. La respuesta a este nuevo reto reconocido será difícil, ya que identifica una limitación intrínseca de la eficacia de casi cualquier anticuerpo natural producido contra el VIH”.
“Este trabajo ayuda a clarificar los obstáculos a los que se enfrentan los anticuerpos a la hora de bloquear la infección”, señala Pamela Bjorkman, profesora de biología en Caltech y coautora del estudio, que añade: “Esperemos que arroje más luz a por qué el desarrollo de una vacuna del VIH ha resultado ser una cuestión tan escurridiza”.
La investigación descrita en el documento contó con el respaldo de una beca de la Fundación Bill y Melinda Gates, concedida a través de la Iniciativa Grandes Retos en la Salud Mundial y la Colaboración en el Descubrimiento de la Vacuna contra el Sida.
Fuente: Physorg.com.
Referencia: Klein JS, Gnanapragasam PNP, Galimidi RP, Foglesong CP, West Jr. AP, and Bjorkman PJ. Examination of the contributions of size and avidity to the neutralization mechanisms of the anti-HIV antibodies b12 and 4E10. Proceedings of the National Academy of Sciences (online): <http://www.pnas.org/content/early/2009/04/15/0811427106.abstract>.










