Las interacciones potenciales entre los nuevos fármacos contra la hepatitis C y los medicamentos antirretrovirales requieren ser caracterizadas en profundidad
Un buen número de estudios presentados en la XVIII Conferencia sobre Retrovirus e Infecciones Oportunistas (CROI) han tenido como protagonistas los nuevos antivirales de acción directa contra el VHC, llamados así porque inhiben la replicación del virus hepático actuando de forma directa contra diferentes fases de su ciclo vital.
Los dos primeros nuevos fármacos orales contra la hepatitis C más avanzados en su desarrollo (fase III) son telaprevir -desarrollado conjuntamente por Vertex y Tibotec/Janssen-Cilag- y boceprevir -de MSD [Merck en EE UU y Canadá]-, dos inhibidores de la proteasa NS3 del VHC los cuales podrían estar disponibles a lo largo de 2011 tras haber adoptado las agencias reguladoras del medicamento europea (EMA) y estadounidense (FDA) la decisión de realizar la revisión acelerada de los datos clínicos disponibles de ambos fármacos para facilitar su aprobación por la vía rápida (véase La Noticia del Día 19/01/2011).
Los resultados de los ensayos efectuados hasta la fecha con ambos fármacos en personas monoinfectadas por VHC muestran, a grandes rasgos y teniendo en cuenta las diferencias respecto a las poblaciones estudiadas y el diseño de los estudios, que añadir uno de ellos al tratamiento estándar (interferón pegilado [IFN-PEG] y ribavirina [RBV]) aumenta de forma significativa las probabilidades de obtener una respuesta virológica sostenida (carga viral indetectable seis meses después de finalizar el tratamiento, lo que equivale a la curación) en personas con VHC de genotipo 1 (el que responde peor a la terapia estándar).
A la espera de que los procedimientos reguladores sigan su curso y se hagan públicas algunas cuestiones importantes relativas a su uso (por ejemplo, cómo será el acceso precoz a dichos fármacos para grupos de pacientes con hepatitis C que tienen necesidades especiales de tratamiento; o cuál será su precio final, dado que, de ser muy elevado, podría ser un obstáculo para su empleo generalizado), la investigación sigue aportando más datos que permiten caracterizar el perfil de eficacia y seguridad de los dos primeros inhibidores de la proteasa del VHC.
Con gran expectación han sido recibidos los primeros resultados preliminares de un ensayo de fase IIa que evalúa el uso de telaprevir (TVR) en combinación con interferón pegilado alfa-2a y ribavirina en pacientes coinfectados por VIH y VHC sin experiencia anterior en el empleo de tratamiento contra la hepatitis C.
Se trata de un estudio a doble ciego y de distribución aleatoria que está evaluando la seguridad, la cinética viral y la eficacia de telaprevir junto con el tratamiento estándar en una población de pacientes coinfectados con VHC de genotipo 1, los cuales fueron repartidos en dos grupos en función de si estaban tomando o no tratamiento antirretroviral. Para los que recibían una terapia estable contra el VIH (<50 copias/mL), los investigadores definieron previamente los dos regímenes antirretrovirales que podían tomar: tenofovir (TDF; Viread®) y emtricitabina (FTC; Emtriva®) junto con efavirenz (Sustiva®; coformulados los tres juntos en Atripla®), o con atazanavir/ritonavir (ATV/r; Reyataz®/Norvir®).
Los participantes fueron distribuidos de forma aleatoria dentro de estas dos categorías (con o sin tratamiento antirretroviral: parte A y B, respectivamente), para tomar una de las dos estrategias siguientes de tratamiento:
– 750mg de telaprevir 3 veces al día + 180 μg/semana de interferón pegilado alfa-2a + ribavirina (a dosis fija: 800 mg/día, o ajustada al peso: 1.000 mg/día en personas de <75kg o 1.200 mg/día en personas de >75kg) durante un período de 12 semanas; a continuación, 36 semanas de terapia estándar (IFN-PEG y RBV).
– Placebo + 180μg de interferón pegilado alfa-2a a la semana + ribavirina (a dosis fija o ajustada al peso) durante 48 semanas.
Cuando el régimen TARGA [terapia antirretroviral de gran actividad] incluyó efavirenz, se requirió ajustar la dosis de telaprevir y aumentarla hasta los 1.125mg, con el fin de contrarrestar la potencial interacción entre ambos fármacos observada en los estudios de farmacocinética con la dosis estándar de telaprevir (750mg).
En general, un 88% de los participantes en este ensayo fueron hombres y un 69%, de etnia blanca; la media de edad fue de 46 años; un 68% tenía VHC de genotipo 1a; un 83% mostraba una carga viral basal elevada (³800.000 UI/mL); y un 10% tenía fibrosis hepática avanzada determinada con antelación por una biopsia.
El análisis preliminar que ahora se presenta corresponde a los datos obtenidos a las semanas 4 y 12 de tratamiento en esta población relativamente pequeña de 59 pacientes coinfectados sin experiencia previa en el uso de terapia contra la hepatitis C.
Los resultados muestran una tasa más elevada de respuesta virológica rápida (RVR: carga viral indetectable a la semana 4), de respuesta virológica precoz completa (RVPc: carga viral indetectable a la semana 12) y de respuesta virológica rápida extendida (RVRe: carga viral indetectable a las semanas 4 y 12) en aquellos participantes que recibieron telaprevir. Dichas tasas de respuesta fueron sobre todo más notables a la semana 4 (70% en los pacientes que recibieron TVR frente a un 5% en aquellos que tomaron el tratamiento estándar). Los datos de eficacia se resumen en la siguiente tabla:
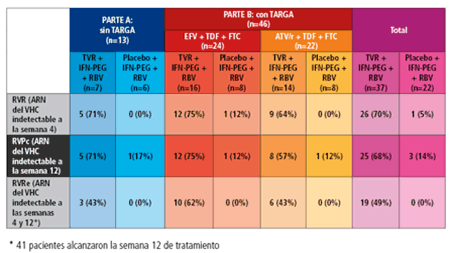
Se produjeron dos recidivas de la carga viral en dos participantes que estaban tomando tratamiento antirretroviral: una a la semana 4 en un paciente del grupo de atazanavir/ritonavir y una a la semana 8 en un paciente del grupo de efavirenz.
Las interrupciones de tratamiento como consecuencia de los efectos secundarios se dieron en 2 de los pacientes (14%) que recibieron telaprevir (en comparación con ninguna en el grupo control): los dos participantes tomaban atazanavir/ritonavir y las causas de la interrupción fueron debidas a anemia e ictericia. Entre las personas a las que se administró telaprevir, los efectos adversos experimentados con más frecuencia fueron fatiga, náuseas, vómitos, fiebre, anorexia y mareos. No se comunicó ningún caso de exantema grave (rash), ni ningún efecto secundario distinto a los registrados en los ensayos de telaprevir en monoinfectados.
Por lo que respecta a los marcadores de la infección por VIH, no se hallaron cambios significativos en cuanto a reducciones de células CD4 o del nivel de la carga viral en los participantes del grupo que estaba tomando cualquiera de los dos regímenes TARGA en comparación con las personas del grupo control. Además, se observaron concentraciones similares de telaprevir tanto en pacientes que estaban tomando tratamiento antirretroviral como en los que no lo recibían.
En sus conclusiones, los investigadores señalan que la tasa de pacientes que consiguieron reducir la carga viral del VHC a las semanas 4 y 12 fue más elevada en los grupos que recibieron la combinación de telaprevir y el tratamiento estándar (IFN-PEG y RBV) que en los grupos de pacientes a los que se administró solo el tratamiento estándar. Añaden que el perfil de seguridad y tolerabilidad de la combinación de telaprevir con interferón pegilado y ribavirina fue parecida a la apreciada en los estudios realizados en personas monoinfectadas por VHC
Con todo, será necesario esperar a que concluya el ensayo para confirmar si los resultados observados a las semanas 4 y 12 se repiten a las semanas 48 (respuesta de fin de tratamiento) y 72 (respuesta virológica sostenida, lo que supone una carga viral indetectable 24 semanas después de la finalización del tratamiento).
Este ensayo, y en particular el uso de dosis más elevadas de telaprevir (1.125mg, 3 veces al día) en los pacientes cuyos regímenes antirretrovirales incluyen efavirenz, pone de manifiesto uno de los principales retos que implica el empleo de los nuevos antivirales de acción directa contra el VHC en personas coinfectadas: las posibles interacciones entre dichos agentes y los fármacos contra el VIH.
Recientemente, un estudio caracterizó las interacciones potenciales entre telaprevir y boceprevir y los fármacos antirretrovirales, llegando a la conclusión de que se podrían esperar interacciones entre una amplia mayoría de fármacos antirretrovirales y los nuevos inhibidores de la proteasa del VHC, lo que se traduciría en la necesidad de una monitorización estrecha y un ajuste en la dosificación o en el tiempo de administración.
En esta misma línea, otro estudio presentado en la CROI evaluó en voluntarios sanos las interacciones farmacocinéticas entre telaprevir y algunos fármacos antirretrovirales: inhibidores de la proteasa potenciados por ritonavir (IP/r), efavirenz y tenofovir. Los investigadores hallaron interacciones entre telaprevir y los IP/r, aunque todavía no se han podido establecer las dosis apropiadas para estos fármacos. Para compensar la potencial interacción de telaprevir con efavirenz (que provoca reducciones de las concentraciones de telaprevir), los expertos proponen aumentar la dosis de TVR a 1.125mg cada 8 horas.
Todos estos aspectos relativos a la seguridad y eficacia de los nuevos antivirales de acción directa contra el VHC en personas coinfectadas deberían ser conocidos y descritos en profundidad para que los pacientes que más los precisen puedan beneficiarse de su uso lo más pronto posible y sin comprometer su salud.
Asimismo, al igual que ha sucedido en los ensayos en pacientes monoinfectados por VHC, urge caracterizar la seguridad y eficacia de estos nuevos fármacos en personas coinfectadas que no respondieron con anterioridad al tratamiento estándar contra la hepatitis C y en los que el empleo de los nuevos antivirales permitiría ampliar las posibilidades de eliminar el VHC y frenar la progresión de la enfermedad hepática.
Por fortuna, el panorama es alentador: a telaprevir y boceprevir, les siguen un buen número de medicamentos en diferentes fases de investigación que, junto con los primeros, proporcionarán, en un futuro no muy lejano, a médicos y pacientes, un nuevo arsenal terapéutico y esperanzas de curación de la hepatitis C.
Fuente: Elaboración propia.
Referencias: Sulkowski M, Dieterich D, Sherman K, Rockstroh J, et al. Interim Analysis of a Phase 2a Double-bind Study of TVR in Combination with pegIFN-a2a and RBV in HIV/HCV Co-infected Patients.18th Conference on Retroviruses & Opportunistic Infections (CROI 2011). Boston. February 27-March 2, 2011. Abstract 146LB.
Van Heeswijk R, Vandevoorde A, Boogaerts G, el al. Pharmacokinetic Interactions between ARV Agents and the Investigational HCV Protease Inhibitor TVR in Healthy Volunteers. 18th Conference on Retroviruses & Opportunistic Infections (CROI 2011). Boston. February 27-March 2, 2011. Abstract 119.
Seden K, Back D and Khoo S. New directly acting antivirals for hepatitis C: potential for interaction with antiretrovirals. J Antimicrob Chemother. 2010 Jun; 65(6): 1.079-1.085.










